Главная »
Диагностика и рациональная терапия хронической боли у онкологических пациентов [Новость добавлена - 31.08.2018]
Новые рекомендации междисциплинарной группы российских экспертов
Диагностика и рациональная терапия хронической боли у онкологических пациентов №02 2018
Онкология Современная онкология - Диагностика и рациональная терапия хронической боли у онкологических пациентов
Номера страниц в выпуске:5-17
Для цитированияСкрыть списокПоддубная И.В., Яхно Н.Н., Мартынов А.И., Насонов Е.Л., Лила А.М., Невзорова Д.В., Абузарова Г.Р., Каратеев А.Е., Кукушкин М.Л., Чурюканов М.В., Котовская Ю.В, Маневич Т.М., Палехов А.В.. Диагностика и рациональная терапия хронической боли у онкологических пациентов. Современная онкология. 2018; 02: 5-17
Для цитирования: Поддубная И.В., Яхно Н.Н., Мартынов А.И., Насонов Е.Л., Лила А.М., Невзорова Д.В., Абузарова Г.Р.,
Каратеев А.Е., Кукушкин М.Л., Чурюканов М.В., Котовская Ю.В, Маневич Т.М., Палехов А.В. Диагностика и рациональная терапия хронической боли у онкологических пациентов. Междисциплинарный консенсус экспертов. Современная Онкология. 2018; 20 (2): 5–17. DOI: 10.26442/1815-1434_2018.2.5-17
Multidisciplinary consensus of expert
Состав экспертной группы
Поддубная Ирина Владимировна – акад. РАН, д-р мед. наук, проф., зав. каф. онкологии, проректор по учебной работе
и международному сотрудничеству ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Яхно Николай Николаевич – акад. РАН, д-р мед. наук, проф., проф. каф. нервных болезней лечебного фак-та, дир.
научно-образовательного клинического центра неврологии ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М.Сеченова» Минздрава России, президент Российского общества по изучению боли
Мартынов Анатолий Иванович – акад. РАН, д-р мед. наук, проф., проф. каф. госпитальной терапии №1 лечебного фак-та ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И.Евдокимова» Минздрава России, президент Российского научного медицинского общества терапевтов
Насонов Евгений Львович – акад. РАН, д-р мед. наук, проф., президент Ассоциации ревматологов России, гл. внештатный специалист-ревматолог Минздрава России
Лила Александр Михайлович – д-р мед. наук, проф., врио дир. ФГБНУ «Научно-исследовательский институт ревматологии им. В.А.Насоновой» Минздрава России
Невзорова Диана Владимировна – канд. мед. наук, зам. дир. ГБУЗ «Московский многопрофильный центр паллиативной помощи» Департамента здравоохранения г. Москвы, гл. внештатный специалист по паллиативной помощи Минздрава России, председатель правления Ассоциации профессиональных участников хосписной помощи
Абузарова Гузель Рафаиловна – д-р мед. наук, рук. Центра паллиативной помощи онкологическим больным ФГБУ «Московский научно-исследовательский онкологический институт им. П.А.Герцена» – филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России
Каратеев Андрей Евгеньевич – д-р мед. наук, зав. лаб. гастроэнтерологических проблем у пациентов с ревматологическими заболеваниями ФГБНУ «Научно-исследовательский институт ревматологии им. В.А.Насоновой» Минздрава России
Кукушкин Михаил Львович – д-р мед. наук, проф., рук. лаб. фундаментальных и прикладных проблем боли ФГБНУ «Научно-исследовательский институт общей патологии и патофизиологии» РАН, ответственный секретарь Российского общества по изучению боли
Чурюканов Максим Валерьевич – канд. мед. наук, доц. каф. нервных болезней лечебного фак-та ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М.Сеченова» Минздрава России
Котовская Юлия Викторовна – д-р мед. наук, проф., зав. лаб. сердечно-сосудистого старения Российского геронтологического научно-клинического центра
Маневич Татьяна Михайловна – канд. мед. наук, рук. Клиники боли Российского геронтологического научно-клинического центра
Палехов Александр Владимирович – рук. краевого центра паллиативной медицинской помощи взрослому населению в Ставропольском крае, гл. специалист Министерства здравоохранения Ставропольского края по противоболевой терапии, рук. курса «Паллиативная медицинская помощь» кафедры онкологии и лучевой терапии с курсом ДПО ФГБОУ ВО «Ставропольский государственный медицинский университет» Минздрава России, заслуженный врач России
2. Классификация показаний к лечебным вмешательствам по степени доказательной эффективности
3. Методология разработки клинических рекомендаций
4. Классификация и патогенез онкологической боли
5. Виды боли при онкологических заболеваниях: определение, терминология
6. Диагностика болевого синдрома
7. Диагностика нейропатической боли
8. Лечение онкологической боли
8.1. Фармакотерапия боли слабой интенсивности (1-я ступень)
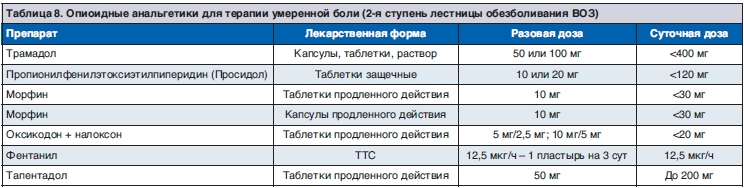
8.2. Фармакотерапия боли умеренной интенсивности (2-я ступень)
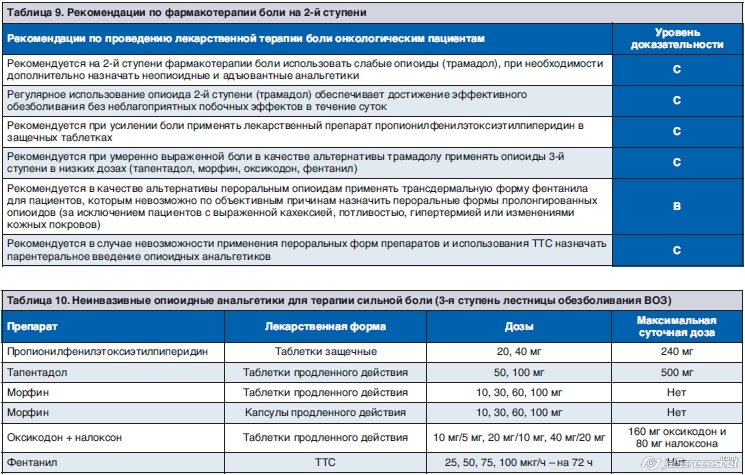
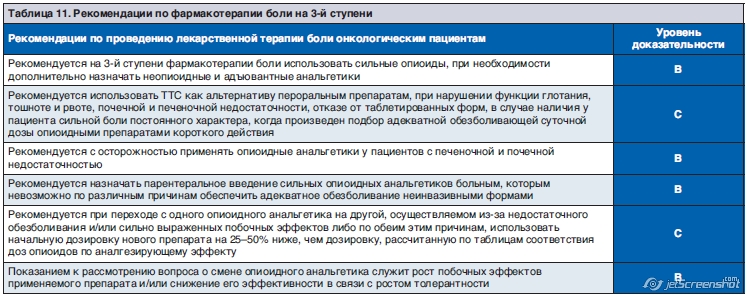
8.3. Фармакотерапия боли выраженной интенсивности (3-я ступень)
9. Лечение нейропатической боли в онкологии
9.1. Препараты, применяемые для лечения нейропатической боли в онкологии
9.1.1. Модуляторы кальциевых каналов (габапентиноиды)
9.1.2. Антидепрессанты – ингибиторы обратного захвата моноаминов
9.1.3. Селективные ингибиторы обратного захвата серотонина и норадреналина
9.1.4. Трициклические антидепрессанты
10. Алгоритм фармакотерапии онкологической нейропатической боли
1. Введение. Общие вопросы
Около 700 тыс. человек последнего года жизни в нашей стране нуждаются в паллиативной помощи. Боль – самая распространенная причина страданий неизлечимых пациентов. Согласно определению паллиативная медицинская помощь направлена на избавление от боли и иных тяжелых проявлений неизлечимых заболеваний с целью улучшения качества жизни (№323-ФЗ «Об основах охраны здоровья граждан»). Однако в силу ряда причин проблема оказания противоболевой помощи пациентам в паллиативной медицине остается недостаточно решенной, и с назначением лекарственной терапии боли нередко возникают серьезные проблемы.
В структуре заболеваний, сопровождаемых развитием болевого синдрома, онкологические занимают первое место по частоте встречаемости боли. Последняя является одним из основных симптомов, причиняющих страдания при злокачественных новообразованиях (ЗНО). Несмотря на выдающиеся успехи, достигнутые в диагностике и терапии опухолей, по прогнозам экспертов Всемирной организации здравоохранения (ВОЗ) в ближайшем будущем заболеваемость и смертность от онкологических заболеваний будут увеличиваться, соответственно, будет расти число пациентов с болевым синдромом, обусловленным опухолевым процессом.
В России насчитывается свыше 3 млн 600 тыс. человек с установленным диагнозом ЗНО, из них ежегодно умирают около 300 тыс., и выявляется более 617 тыс. новых случаев заболевания. На начальных стадиях опухолевого процесса у 35–50% пациентов диагностируется болевой синдром, при прогрессировании ЗНО их число увеличивается до 75%, а в терминальной стадии – до 95–100%. Таким образом, число онкологических больных, нуждающихся в обезболивающей терапии, значительно превышает число умерших от ЗНО и только в нашей стране составляет более 430 тыс. пациентов [1].
В связи с этим, по мнению экспертов, представляющих ведущие российские профессиональные медицинские сообщества, назрела необходимость разработки клинических рекомендаций по диагностике и лечению болевого синдрома у онкологических пациентов. Учитывая важное обстоятельство, когда врачи различных специальностей могут быть задействованы в диагностике и терапии пациентов с болью при онкологических заболеваниях, настоящие рекомендации должны быть созданы совместными усилиями экспертов, представляющих разные медицинские специальности.
По инициативе ведущих экспертов Российского общества по изучению боли, Российского научного медицинского общества терапевтов, Ассоциации профессиональных участников хосписной помощи, Российской ассоциации геронтологов и гериатров, Ассоциации ревматологов России разработаны клинические рекомендации по диагностике и лечению хронической боли у онкологических больных.
Данный документ посвящен практическим аспектам диагностики и лечения болевого синдрома у онкологических больных. В рекомендациях изложены порядок и правила назначения обезболивающих препаратов, в том числе опиоидных анальгетиков, а также выписывания рецептов в амбулаторных и стационарных условиях. Рекомендации предназначены онкологам, специалистам по паллиативной медицинской помощи, терапевтам, врачам общей практики и врачам любых специальностей, к которым могут обратиться пациенты с онкологическими заболеваниями и болевым синдромом.
2. Классификация показаний к лечебным вмешательствам по степени доказательной эффективности
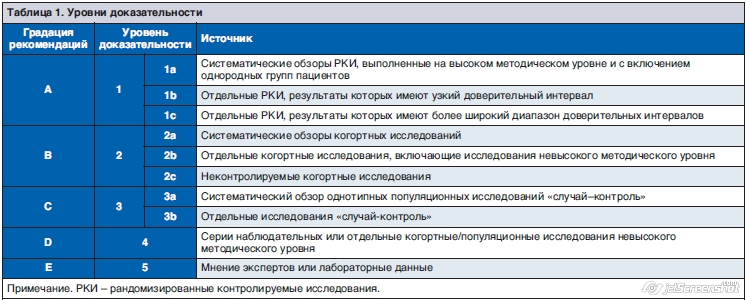
В течение последних двух десятилетий мировое сообщество использует классификацию показаний к лечебным и диагностическим вмешательствам по степени доказательной эффективности (табл. 1).
3. Методология разработки клинических рекомендаций
В клинических рекомендациях приведены правила фармакотерапии хронического болевого синдрома у онкологических пациентов с учетом перечня опиоидных анальгетиков, зарегистрированных в России. В соответствии с рекомендациями ВОЗ, а также Европейскими рекомендациями по паллиативной медицине основным методом контроля хронического болевого синдрома является фармакотерапия на основе неинвазивных форм опиоидных анальгетиков. Она применяется амбулаторно и в стационаре независимо от стадии заболевания. Полноценный контроль боли должен осуществляться на всех этапах лечения пациента, в том числе при оказании паллиативной медицинской помощи.
При подготовке клинических рекомендаций применялась современная рейтинговая оценка силы доказательств по системе GRADE. Доказательной базой для рекомендаций стали также публикации, вошедшие в библиотеку Cochrane, базы данных EMBASE и MEDLINE. Глубина поиска составила 15 лет. Для оценки качества и силы доказательств применялась таблица уровней доказательности (см. табл. 1). При формулировании рекомендаций использовался консенсус экспертов. При изложении текста рекомендаций приводятся уровни доказательности (1, 2, 3, 4), а также уровни рекомендаций (A, B, С, D).
Порядок обновления клинических рекомендаций – 1 раз в 3 года.
Клинические рекомендации будут обновляться таким образом, чтобы учесть все появляющиеся важные рекомендации в лечении хронической боли. Плановый срок их обновления – через 3 года после их утверждения. Учитывая малочисленность исследований в области лечения хронической боли у пациентов паллиативного профиля, а также отсутствие в настоящее время ряда необходимых опиоидных анальгетиков в различных формах, обновление рекомендаций в объеме пересмотра части их или документа в целом возможно в более короткие (ранние) сроки в случае опубликования новых важных фактов.
4. Классификация и патогенез онкологической боли
Хронический болевой синдром является самостоятельным заболеванием. Он не исполняет защитной функции и не несет никакой биологической целесообразности. Напротив, хроническая боль ведет к дезадаптации, ненормальному восприятию болевых и неболевых импульсов и сопровождается различными нарушениями функций центральной нервной системы (ЦНС). Клиническая картина зависит от локализации очага поражения, конституции больного, его психики и индивидуального порога болевой чувствительности, предшествующего болевого опыта [2, 3].
Основной причиной возникновения хронического болевого синдрома является длительно существующая постоянная боль, которая вызывает дисбаланс в работе периферической нервной системы и ЦНС. Нейрональные рецепторы и волокна в этом случае подвергаются постоянной активизации, что приводит к возрастающей стимуляции ЦНС (спинного и головного мозга) болевыми раздражителями. Одна из основных причин хронической боли – появление комплексов гиперреактивных нейронов на разных уровнях ЦНС. Их патологическая активность обусловлена поломкой механизмов нейронального торможения, повышенной возбудимостью нейронов и активацией неактивных синапсов, что объединяет эти нейроны в очаг возбуждения с самоподдерживающейся эктопической активностью, которая приводит к функциональным, структурным и адаптивным (нейропластическим) изменениям в головном и спинном мозге, из-за чего боль продолжается, даже когда ее причина устранена [4, 5].
Онкологическую боль классифицируют по различным критериям: временному фактору (острая, хроническая), локализации (орофациальная, тазовая, абдоминальная, боль в костях и т.д.), причине, ее вызывающей (как результат роста опухоли, противоопухолевой терапии, следствие паранеопластического синдрома, боль при конкурирующих заболеваниях).
Онкологическая боль имеет отчасти ту же природу и те же патофизиологические механизмы, какие формируются при воспалении и повреждении тканей. Общим является то, что основной причиной возникновения боли служит раздражение специфических болевых рецепторов – ноцицепторов, которые распределены в разных органах и тканях: коже, слизистых оболочках, стенках полых органов, капсулах паренхиматозных органов, а также в губчатой и минеральной составляющей костей и надкостнице.
Однако боль, вызванная злокачественным опухолевым процессом, имеет и свою специфику (табл. 2). Опухолевые клетки быстро растут, сдавливая прилежащие здоровые ткани, которые чувствительны к механическим воздействиям (висцеральные боли), либо прорастают или сдавливают периферические и центральные структуры нервной системы (нейропатическая боль). В процессе развития и роста опухоль выделяет специфические алгогены: эндотелин, простагландины и фактор некроза опухолей a, – которые возбуждают или повышают восприимчивость периферических рецепторов и нервных волокон к сенсорным раздражителям. Опухоли выделяют ионы водорода Н+, что приводит к местному ацидозу, сопровождаемому сходным эффектом. Протеолитические ферменты, вырабатываемые опухолевыми клетками, постоянно возбуждают и дестабилизируют сенсорную симпатическую иннервацию, что приводит к нейропатической боли. Боль, вызванная метастазами опухоли, возникает в результате прямого опухолевого повреждения С-афферентов сенсорных нейронов, иннервирующих костный мозг, а также из-за нарушения баланса между активностью остеокластов и остеобластов. Кости теряют прочность, подвержены остеолизу, патологическим переломам и микропереломам, в результате механическая деформация периоста становится основным источником боли [6].

5. Виды боли при онкологических заболеваниях: определение, терминология
С позиций патофизиологии различают ноцицептивную и нейропатическую боль [7, 8].
Ноцицептивная боль формируется при наличии очага повреждения в тканях (у онкологического больного при их сдавлении, прорастании опухолью) за счет раздражения периферических болевых (ноцицептивных) нервных окончаний (ноцицепторов), что сопровождается освобождением периферических болевых нейротрансмиттеров (простагландин Е2, вещество «Р» и др.), инициирующих возбуждение ноцицепторов и его распространение по афферентным нервным волокнам к нейронам задних рогов спинного мозга. На уровне спинного мозга при участии специальных болевых нейротрансмиттеров осуществляется организация восходящего ноцицептивного потока, который по спиноталамическому тракту поступает к ядрам таламуса, а затем к коре головного мозга, где происходят анализ болевой информации и формирование осознанного ощущения боли. Ноцицептивная боль носит физиологический характер, сигнализируя о неблагополучии в организме и активизируя механизмы, направленные на избавление от боли. Обращение пациента к врачу и назначение ему анальгетических средств, соответствующих интенсивности ноцицептивной боли, приводит к ее устранению. В зависимости от локализации очага боли выделяют соматическую (опорно-двигательный аппарат, кожа, мягкие ткани) и висцеральную (внутренние органы) ноцицептивную боль.
Ноцицептивная соматическая боль возникает в результате повреждения ткани или воздействия на него болезненного агента, в том числе опухоли с последующей активизацией болевых рецепторов (ноцицепторов) в костях, коже, подкожной клетчатке, мышцах и мягких тканях и пр. Эта боль хорошо локализована, может быть приходящей или постоянной, имеет различные описательные характеристики: тупая или острая, давящая, пульсирующая, дергающая, сверлящая, грызущая, распирающая и др. [9].
Ноцицептивная висцеральная боль возникает при повреждении симпатически иннервируемых органов (при поражении поджелудочной железы, стенок желудка и кишечника, растяжении капсулы печени и т.п.). Она плохо локализована, имеет разлитой характер (тупая с приступами обострения, сжимающая, схваткообразная, тянущая, изнуряющая и пр.) [9].
Нейропатическая боль имеет принципиально другое происхождение. Она возникает в результате повреждения нервной системы, которое может произойти на любом ее уровне – от рецепторов до высших отделов ЦНС. При этом нарушается функционирование как периферических, так и центральных механизмов контроля боли. При повреждении нерва повышается его возбудимость, биоэлектрические импульсы могут появляться на всем его протяжении, что вызывает боль в соответствующей зоне иннервации. В поврежденных нейронах возникает спонтанная эктопическая активность, которая вызвана активацией натриевых каналов в поврежденных регенерирующих нервных волокнах. Повышается чувствительность болевых рецепторов в результате усиленного воздействия нейротрансмиттеров (глутамат, субстанция Р и др.) на нейроны. Возникают патологические взаимодействия между нервными волокнами; импульс, идущий от нейрона с поврежденной миелиновой оболочкой, может попадать на соседний нейрон, причем становятся возможными контакты между болевыми и неболевыми сенсорными нейронами, например, передающими тактильную информацию (феномен спраутинга), что приводит к усилению и расширению зоны нейропатического болевого синдрома, извращению сенсорного восприятия. Неболевые (тактильные) импульсы начинают распознаваться как болевые, что увеличивает поток патологической болевой импульсации к нейронам заднего рога, вызывая их дальнейшее патологическое перевозбуждение. Среди центральных механизмов образования нейропатического болевого синдрома выделяют так называемый феномен взвинчивания (wind up-эффект), при котором ответ перевозбужденных нейронов на каждый последующий болевой импульс повышается даже при неизмененной силе этого импульса. Неадекватное повышение возбудимости нейронов (сенситизация) при нейропатической боли является следствием стойкой деполяризации постсинаптической мембраны нейронов ионами кальция [10–16].
Необходимым условием формирования нейропатической боли считается нарушение взаимодействия ноцицептивных (проводящих боль) и антиноцицептивных (тормозящих проведение болевых импульсов) систем с перенапряжением и последующей утратой части антиноцицептивных механизмов, т.е. возникает «дефицит торможения». При этом происходят гибель тормозных интернейронов, снижение концентрации g-аминомасляной кислоты – ГАМК (главного тормозного нейротрансмиттера ЦНС) и уменьшение плотности рецепторов ГАМК в заднем роге спинного мозга, что подавляет проведение тормозных сигналов, поступающих в нейроны заднего рога [17].
Описанные сложные механизмы развития нейропатической боли указывают на необходимость комплексной его терапии с использованием не только классических анальгетических средств, но и специальных агентов, уменьшающих перевозбуждение сенсорных нервных структур на разных уровнях, а также активизирующих механизмы, тормозящие проведение болевой информации [18].
Нейропатическая боль, согласно последним данным, является нередким симптомом и встречается примерно у каждого 3-го онкологического пациента [19].
Нейропатический болевой синдром возникает у больных со ЗНО на разных этапах развития опухолевого процесса, поскольку нервные клетки наиболее чутко реагируют на специфические изменения в организме, происходящие при прогрессировании ЗНО, а также на процессы, возникающие при проведении противоопухолевой терапии [20].
Причины этих изменений зачастую могут быть неясны, но наиболее частыми считаются непосредственное опухолевое повреждение, в том числе осложнения основного опухолевого процесса, которые сопровождаются компрессией нервных сплетений, корешков спинного мозга и нервных структур. С учетом последних исследований в этой области в среднем у 76% онкологических пациентов непосредственно опухолевое повреждение является причиной всех хронических болевых синдромов, осложнения противоопухолевой терапии вызывают боль у 11% больных, паранеопластическая и неопластическая боль регистрируется у 5% и сопутствующие коморбидные процессы – у 8%.
Если отдельно выделять наличие нейропатической боли в этой группе пациентов, то осложнения противоопухолевой терапии вдвое чаще становятся причиной возникновения нейропатической боли (табл. 3) [21].

Отдельным видом нейропатической боли в чистом виде является полинейропатия, вызванная последствиями химиотерапии высокотоксичными препаратами (таксаны, препараты платины), либо фантомная боль в результате ортопедических операций, а также лучевое повреждение нервов [22].
6. Диагностика болевого синдрома
Клиническая картина онкологической боли зависит от нескольких факторов: локализации опухоли, вовлеченности других органов и тканей в процесс, конституции больного, особенностей его психики, индивидуального порога болевой чувствительности и др. Около 40–50% больных описывают свои болевые ощущения как умеренные или выраженные, у 25–30% боль тяжелая или мучительная.
Комплексная оценка болевого синдрома играет очень важную роль в его лечении. Особое значение придается анамнезу болевого синдрома. В каждом случае необходимо выяснить характеристики боли (локализацию, интенсивность, продолжительность, факторы, облегчающие или усиливающие боль), влияние ее на качество жизни.
Для оценки интенсивности боли в качестве удобного и информативного инструмента используют визуальную аналоговую шкалу (ВАШ). Больному предлагается на шкале отметить свое восприятие боли (от минимальной до нестерпимой), что позволяет количественно выразить оценку в процентах от 0 до 100%. Вербальные ранговые шкалы представляют собой набор характеристик боли, отражающих ее интенсивность, которые устно предъявляются пациенту. Интенсивность болевого синдрома по ВАШ оценивается в процентах или баллах от 1 до 10 и интерпретируется по алгоритму, представленному в табл. 4.

Адекватную оценку боли могут затруднять разные факторы, связанные с неподготовленностью медицинского персонала и плохо собранным анамнезом боли, который должен включать следующие важные моменты:
• число и локализацию очагов боли;
• длительность предшествующего болевого анамнеза;
• эффективность предшествующей терапии боли;
• применяемые анальгетики;
• влияние боли на физическую активность;
• влияние боли на продолжительность ночного сна;
• влияние боли на возможность приема пищи и пр.
7. Диагностика нейропатической боли
Диагностика нейропатической боли должна базироваться на сочетании данных анамнеза, клинического исследования чувствительности и инструментальных данных, подтверждающих поражение структур соматосенсорной системы. Выявление нейропатической боли у пациентов должно носить активный характер и быть неотъемлемой частью сбора анамнеза с уточнением наличия и характера боли.
Нейропатическая боль имеет некоторые особенности. Прежде всего она сопровождается специфическими чувствительными расстройствами. Весьма характерной для нейропатической боли является аллодиния – появление боли в ответ на стимул, который в нормальных условиях не вызывает ее. В таких случаях больные испытывают сильные боли при малейшем прикосновении, иногда даже при дуновении ветра. Различают температурную и механическую аллодинию. Последняя подразделяется на статическую, которая появляется при давлении на фиксированную точку кожного покрова, и динамическую, возникающую при движущихся стимулах, например легком раздражении кожи кисточкой или пальцем.
При нейропатической боли часто наблюдаются гиперестезия, гипералгезия, гиперпатия, невралгия. При гипералгезии чувствительность к болевому стимулу оказывается значительно выше, чем ожидается в норме. При гиперпатии субъективный ответ как на болевой, так и неболевой стимулы является чрезмерным и часто сохраняется в течение долгого времени уже после прекращения раздражения. Пациента могут также беспокоить спонтанные боли, возникающие при очевидном отсутствии какого-либо внешнего воздействия. Они, как правило, носят жгучий, колющий характер. Чувство щекотания, безболезненного покалывания или другие подобные ощущения относятся к парестезиям; если эти ощущения причиняют боль, то их называют дизестезиями.
Примером аллодинии могут служить фантомный, пост-торакотомический или постмастэктомический синдромы, когда спустя даже длительное время после оперативного вмешательства у некоторых больных отмечается резкая болезненность или невыносимое жжение в области послеоперационной раны, которые могут возникать даже от легкого касания кожи носимой одеждой, при этом более сильное надавливание в этой зоне не вызывает подобной болевой реакции.
Боли нейропатической природы могут возникать спонтанно, без какой-либо видимой причины, при этом они имеют простреливающий, «как удар электротоком», или жгучий характер, способны усиливаться при психоэмоциональных переживаниях и под влиянием индифферентных раздражителей. Такими бывают постампутационные фантомные боли после хирургического пересечения нервных стволов, если не проводились мероприятия по профилактике фантомного болевого синдрома.
Одним из наиболее тяжелых вариантов нейропатической боли является каузалгия, или так называемая симпатически усиленная боль, развивающаяся вследствие нарушения периферической иннервации в периферических ноцицептивных и постганглионарных симпатических волокнах (после операции или при росте опухоли). При этом описанные выше сенсорные расстройства сочетаются с признаками гиперактивности тканей, иннервируемых симпатическими нервами. Они выражаются в вазомоторных реакциях (локальная гиперемия или бледность кожи), трофических изменениях тканей, гипергидрозе (например, при рецидиве опухоли в зоне удаленной молочной железы). Каузалгия особенно трудно поддается терапии.
Для облегчения идентификации нейропатической боли были разработаны скрининговые шкалы: Leeds Assesment of Neuropathic Symptoms and Signs – LANSS (Лидская шкала оценки нейропатических симптомов и признаков), Douleur Neuropathic 4 – DN4 (диагностический опросник нейропатической боли), Pain DETECT, Neuropathic Pain Questionnaire (опросник нейропатической боли), ID Pain и др. Каждая шкала характеризует нейропатическую боль путем наличия позитивных и негативных симптомов и знаков, включающих спонтанную боль, парестезии, дизестезии, аллодинию, двигательный и чувствительный дефект. Учитывая важность определения наличия нейропатической боли для дальнейшего лечения, обязательны надежность, валидность и диагностическая точность подобных шкал. Опросники Pain DETECT и Standardized Evaluation of Pain – StEP (стандартизированная оценка боли) позволяют дифференцировать нейропатический и ненейропатический характер боли на основе вербальных дескрипторов с ограниченным клиническим обследованием или без такового.
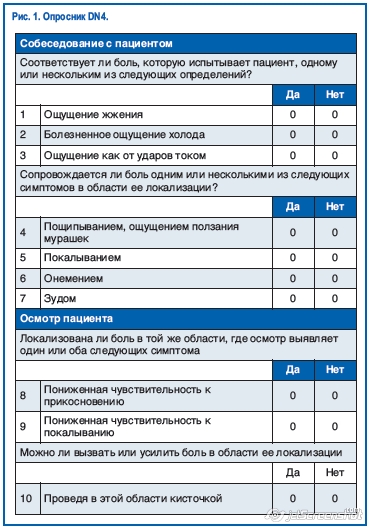 В настоящее время одним из самых чувствительных в отношении выявления нейропатической боли является опросник DN4 (рис. 1).
В настоящее время одним из самых чувствительных в отношении выявления нейропатической боли является опросник DN4 (рис. 1).
При положительном ответе на 4 и более вопросов из 10 пунктов этого опросника диагноз «нейропатическая боль» становится обоснованным. Чувствительность методики DN4 (число пациентов с нейропатической болью, у которых выявляется эта патология по результатам тестирования) составляет 80%, что позволяет использовать ее в качестве скрининга для выявления нейропатических болевых синдромов. При этом специфичность опросника не столь высока.
Данные количественного сенсорного тестирования с использованием контролируемых физиологических стимулов, таких как температура, давление, укол и вибрация, используются для точной верификации чувствительных нарушений при нейропатической боли. Изменения по данным соматосенсорных и лазерных вызванных потенциалов характерны для нейропатической боли, но имеют ограниченное диагностическое значение. Количественное сенсорное тестирование и нейрофизиологические данные могут быть использованы у пациентов с нейропатической болью, когда поражение трудно зафиксировать по данным клинического обследования, для исключения других причин боли и изучения механизмов развития болевого синдрома.
Указанные сенсорные расстройства значительно утяжеляют течение болевого синдрома у пациентов с онкологическими заболеваниями, нарушают сон и психологическое состояние, приводят к развитию депрессии, частота которой при нейропатической боли достигает 80% по сравнению с 10–12% при ноцицептивном болевом синдроме. Депрессия, в свою очередь, способствует усилению болевого синдрома и затрудняет его терапию. Поэтому лечение нейропатической боли должно быть начато как можно раньше.
Дифференциальная диагностика типов боли, оценка предыдущего и настоящего лечения и их побочных эффектов и осложнений позволяют найти наилучшую безопасную и эффективную комбинацию анальгетиков, добиться наиболее высокого качества жизни пациента при минимуме препаратов и побочных эффектов (рис. 2).
8. Лечение онкологической боли
Терапия болевых синдромов в онкологической клинике – это сложная, но в большинстве случаев решаемая проблема при условии правильной диагностики типа и причины возникновения боли. Главным методом лечения хронического болевого синдрома у онкологического больного является фармакотерапия, осуществляемая на основе ступенчатого принципа, рекомендованного ВОЗ.
ВОЗ предложила трехступенчатую лестницу обезболивания (рис. 3) [23], важнейшим условием использования которой является необходимость оценки интенсивности боли, проведенной самим пациентом, а анальгетики разделены на неопиоидные и опиоидные (слабые и сильные), причем в каждой группе определены основные и альтернативные препараты. ВОЗ включила опиоидные анальгетики в трехступенчатую схему терапии неонкологической боли, когда физиотерапия, массажи и лечение другими анальгетическими препаратами (парацетамол, нестероидные противовоспалительные препараты – НПВП, трициклические антидепрессанты – ТЦА, антиконвульсанты) не могут обеспечить достаточный контроль над болью и качеством жизни больного. Исследовательский отдел Европейской Ассоциации по Паллиативной помощи (ЕАПП) в 2012 г. провел научную оценку рекомендаций ВОЗ в части использования опиоидов на основе современных методов доказательной медицины по системе GRADE и опубликовал свои рекомендации под названием «Использование опиоидных анальгетиков для обезболивания при злокачественных новообразованиях: доказательные рекомендации ЕАПП», где были пересмотрены и уточнены некоторые положения фармакотерапии онкологической боли, провозглашенные ВОЗ в 1996 г. В качестве препаратов для лечения умеренной боли рекомендовано использовать не только слабые, но и сильные опиоиды в низких дозировках.

Основные принципы обезболивания:
• дозы анальгетика подбираются начиная с высоких дозировок слабых препаратов с переходом к низким дозам более сильных [24, 25];
• необязательно последовательно идти от одной ступени к другой: пациент с тяжелым болевым синдромом сразу может нуждаться в сильных опиоидных анальгетиках;
• переход с одной ступени обезболивания на следующую определяется усилением боли, недостаточным ответом на применяемую обезболивающую терапию и побочными эффектами лекарственных препаратов у конкретного пациента (табл. 5).

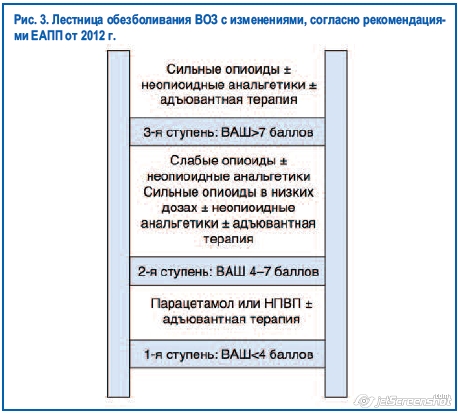
8.1. Фармакотерапия боли слабой интенсивности (1-я ступень)
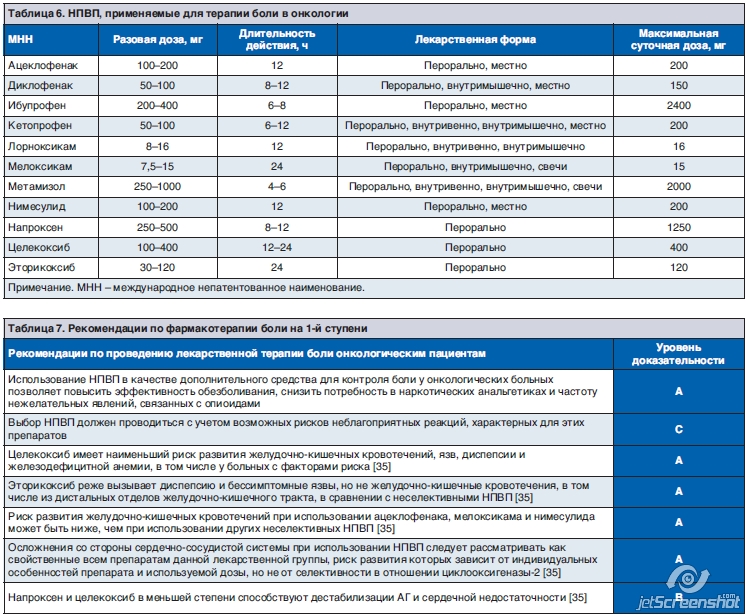
НПВП играют важную роль в анальгетической терапии при онкологических заболеваниях [26]. В ряде случаев (при умеренно выраженной боли) они могут использоваться как монотерапия, но наиболее часто их применяют в комплексе с опиоидными анальгетиками. По данным РКИ [27–31] и соответствующего метаанализа, включавшего данные 42 РКИ (n=3084), при онкологической боли НПВП достоверно превосходят плацебо. В недавно опубликованных 11 РКИ разного типа, включая открытые (n=949), было продемонстрировано снижение боли с высокой до умеренной у 26–51% больных, получавших НПВП [32].
Данные о повышении эффективности обезболивания при комбинации НПВП и опиоидов носят противоречивый характер. Так, из 14 РКИ, в которых изучали этот вопрос, в 5 не отмечено различия между комбинированной терапией и монотерапией опиоидами, а в 9 показано статистически достоверное (хотя и небольшое) преимущество комбинации НПВП и опиоидов [33].
Имеются ограниченные данные, демонстрирующие дополнительное благоприятное действие НПВП у больных с поздними стадиями онкологических заболеваний на фоне раковой кахексии: улучшение качества жизни и внешнего вида, повышение массы тела [34].
Выбор НПВП должен проводиться с учетом возможных рисков развития неблагоприятных реакций, характерных для этих препаратов, а также рисков проводимого противоопухолевого лечения (табл. 7).
8.2. Фармакотерапия боли умеренной интенсивности (2-я ступень)
8.3. Фармакотерапия боли выраженной интенсивности (3-я ступень)
В этих случаях назначаются сильнодействующие опиоидные анальгетики (тапентадол, оксикодон, морфин, фентанил) либо высокие дозы Просидола (непродолжительно) как переходного анальгетика (табл. 10, 11).
9. Лечение нейропатической боли в онкологии
У онкологических больных нейропатическая боль чаще всего имеет сочетанный характер и возникает как компонент уже имеющегося висцерального или соматического болевого синдрома, по поводу которого пациенты, как правило, получают опиоидные и неопиоидные анальгетики, однако эти препараты только частично ослабляют проявления нейропатии, поскольку не способны воздействовать на ее причины. В этих случаях противоболевая терапия должна быть комплексной, и анальгетики, блокирующие ноцицептивную (висцеральную и соматическую) боль, должны быть дополнены специальными препаратами для лечения нейропатической боли.
Основными средствами для лечения нейропатической боли любого, в том числе и онкологического генеза, являются препараты из группы антидепрессантов (амитриптилин, дулоксетин, венлафаксин) или антиконвульсантов (карбамазепин, габапентин, прегабалин) [36] (рис. 4).
Эффективность этих препаратов объясняется патогенезом нейропатической боли. ТЦА угнетают обратный захват серотонина и норадреналина в пресинаптических нейронах, активизируя тем самым нисходящее торможение на процесс боли. Кроме того, препараты этой группы в некоторой степени блокируют натриевые каналы периферических нервов и являются антагонистами NMDA-рецепторов, участвующих в процессе формирования боли.
Антиконвульсанты, изначально применяемые при эпилепсии, также показали себя эффективными средствами при нейропатической боли. Антиконвульсанты I поколения (фенитоин, карбамазепин и др.) демонстрируют анальгетический эффект за счет блокирования натриевых и кальциевых каналов периферических нервов; препараты II поколения (габапентин, прегабалин) тормозят высвобождение нейротрансмиттеров – медиаторов боли (глутамат, субстанция Р, норадреналин) и замедляют передачу нервного импульса [37].
Среди антиконвульсантов наиболее эффективными препаратами для лечения нейропатической боли считаются габапентин и прегабалин, которые являются препаратами 1-й линии во всех ведущих рекомендациях по лечению нейропатической боли неврологических и онкологических сообществ Европы и США, включая рекомендации неврологов и онкологов России.
Эффективность прегабалина и габапентина подтверждена международными рандомизированными клиническими исследованиями, в том числе при лечении нейропатической боли у онкологических пациентов, принимающих опиаты. Прегабалин доказал свою эффективность у онкологических больных при периферической нейропатии, индуцированной химиотерапией. В проведенном исследовании наибольшую эффективность по сравнению с опиоидами, НПВП и карбамазепином показал прегабалин [38].
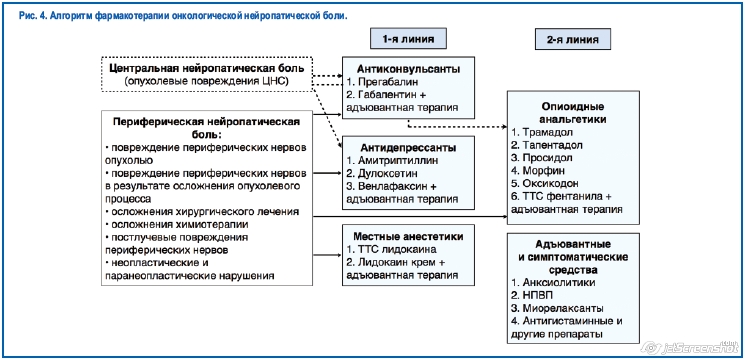
9.1. Препараты, применяемые для лечения нейропатической боли в онкологии
9.1.1. Модуляторы кальциевых каналов (габапентиноиды)
В эту группу входят два препарата с близким строением молекулы – габапентин и прегабалин. Они являются производными ГАМК (англ. аббревиатура GABA, откуда и образовалось название группы «габапентиноиды»). Препараты этой группы связываются не с рецепторами ГАМК, а с a2d-субъединицей потенциалзависимых кальциевых каналов нейронов, что вызывает уменьшение поступления ионов Ca2+ в пресинаптические окончания нейронов, находящихся в состоянии гипервозбуждения. Это ведет к торможению выхода возбуждающих нейромедиаторов в синаптическую щель и замедлению передачи нервного импульса на следующий нейрон. Габапентиноиды действуют только на «перевозбужденные» нейроны в заднем роге спинного мозга и ЦНС и не влияют на нормально функционирующие нейроны.
Габапентин – первый габапентиноид, внедренный в клиническую практику.
Режим дозирования: начальная доза 300 мг 1 раз в сутки, на 2-й день – 300 мг 2 раза в сутки, на 3-й – 300 мг 3 раза в сутки. В дальнейшем дозировку постепенно увеличивают до достижения эффекта, возможно, до 1800–3600 мг/сут.
В 2017 г. в Российской Федерации была зарегистрирована новая дозировка препарата 600 мг таблетка с риской.
Минимальная продолжительность тестовой терапии составляет от 3 до 8 нед титрования дозы плюс не менее
2 нед приема в максимальной переносимой дозе.
Дополнительные положительные эффекты: противотревожный, седативный.
Наиболее частые побочные эффекты: сонливость, головокружение, атаксия, слабость, периферические отеки. Они могут быть более выраженными у пациентов пожилого и старческого возраста.
Основные противопоказания: повышенная чувствительность к препарату, беременность и лактация, дети до 17 лет.
Меры предосторожности: пациентам с нарушениями функции почек, а также больным, находящимся на гемодиализе, требуется коррекция режима дозирования.
Лекарственные взаимодействия: практически отсутствуют. Антациды уменьшают всасывание габапентина из желудочно-кишечного тракта.
Прегабалин является самым изученным антиконвульсантом в лечении нейропатической боли. Его молекула представляет собой модифицированную молекулу габапентина. Сродство молекулы прегабалина к a2d-субъединице Ca2+ канала в 6 раз выше, чем габапентина, а всасывание является линейным и зависит от дозы, что также в положительную сторону отличает прегабалин от габапентина.
В связи с этими особенностями фармакокинетики обезболивающий эффект наступает раньше, чем у габапентина, длительный период подбора дозы не требуется.
Режим дозирования: начальная доза – 25–75 мг 1–2 раза в сутки, с 3 по 7-й день – по 150 мг 2 раза в сутки, далее при необходимости – по 300 мг 2 раза в сутки.
Минимальная продолжительность тестовой терапии: 2–4 нед в максимальной переносимой дозировке.
Дополнительные положительные эффекты: стойкое улучшение сна и уменьшение хронической патологической тревоги, часто сопутствующей болевому синдрому.
Наиболее частые побочные эффекты: головокружение (21–46% больных), сонливость (14–46%), эйфория; реже – периферические отеки, прибавка массы тела, слабость, головная боль, сухость во рту, атаксия. Обычно головокружение и сонливость возникают в 1 или 2-й день приема препарата и проходят через 6–17 дней (головокружение) или 26–31 день (сонливость), о чем следует предупредить больного заранее. Из-за плохой переносимости от приема доз 150–300 мг/сут отказываются 2,6 и 2,1% больных, соответственно, от приема дозы 600 мг/сут – до 28%. Как и при приеме любых психотропных средств, побочные эффекты чаще проявляются у пациентов преклонного возраста, которым в связи с этим требуется назначать препарат в меньшей начальной дозе и титровать дозировки медленнее.
Основные противопоказания: повышенная чувствительность к препарату, беременность и лактация, дети до 17 лет.
Меры предосторожности: с осторожностью – при отеках (сердечная, почечная недостаточность).
Лекарственные взаимодействия: возможно усиление эффекта седативных препаратов.
9.1.2. Антидепрессанты – ингибиторы обратного захвата моноаминов
Препараты, ингибирующие обратный захват моноаминов (серотонина и норадреналина), повышают концентрацию этих нейротрансмиттеров в синаптической щели и оказывают непосредственное влияние на ингибирующую активность нисходящих нейронов, влияя на центральные механизмы болевой перцепции. Их обезболивающий эффект не зависит от антидепрессивного.
В эту группу относят селективный ингибитор обратного захвата серотонина и норадреналина дулоксетин и ТЦА.
В связи с тем, что ТЦА не являются селективными препаратами, они помимо моноаминов действуют на центральные гистаминовые рецепторы, а также обладают холинолитическим, a-адреноблокирующим и b-адреностимулирующим и хинидиноподобным эффектами, что определяет их худшую переносимость и большее число противопоказаний, чем у селективных ингибиторов обратного захвата серотонина и норадреналина.
9.1.3. Селективные ингибиторы обратного захвата серотонина и норадреналина
Дулоксетин
Режим дозирования: начальная доза – 60 мг 1 раз в сутки, эффективные обезболивающие дозы – 60 и 90 мг 1 раз в сутки и 120 мг/сут в 2 приема. В связи с тем, что в первые 1–2 нед использования дозы 60 мг у некоторых пациентов может появляться тревога, которая проявляется нарушением сна, тахикардией или легкой тошнотой («норадреналиновые эффекты»), можно начинать прием с 30 мг/сут с увеличением дозы до 60 мг через неделю. Альтернативой является комбинация 60 мг дулоксетина с небольшими дозами любого седативного препарата (валерианы 2–3 таблетки в сутки; тофизопама 50 мг 2 раза в сутки; гидроксизина 12,5–25 мг/сут в 1 или 2 приема; тиаприда 50 мг 2 раза в сутки; феназепама 0,025 мг 1–2 раза в сутки и т.д.). Через 2–3 нед противотревожный препарат отменяют, а прием дулоксетина продолжают.
Минимальная продолжительность тестовой терапии: не менее 4 нед в максимальной переносимой дозе. У большинства пациентов уменьшение болевого синдрома отмечается уже в первые дни приема препарата.
Дополнительные положительные эффекты: доказанное улучшение качества жизни, нарушенного в связи с болевой диабетической периферической нейропатией, антидепрессивный эффект.
Наиболее распространенные побочные эффекты: на дозе 60 мг – нарушения сна (трудности засыпания или сонливость), легкая тошнота, тахикардия, склонность к запорам; на более высоких дозах – сухость во рту, потливость, усиление или, чаще, снижение аппетита. Из-за побочных эффектов от приема препарата в дозе 60 мг/сут отказываются 4–10% больных, 120 мг/сут – 12–19%. В плацебо-контролируемых исследованиях дулоксетин не повышал уровень гликированного гемоглобина у больных сахарным диабетом; клинически незначимое повышение (разница 0,33% с контрольной группой) отмечалось лишь в одном долгосрочном исследовании. У пожилых пациентов побочные эффекты способны проявляться сильнее, их выраженность можно уменьшить назначением меньших начальных доз и более медленным титрованием.
Противопоказания: декомпенсированная закрытоугольная глаукома, повышенная чувствительность к препарату, лактация.
С предосторожностью: печеночная недостаточность, почечная недостаточность со скоростью клубочковой фильтрации менее 30 мл/мин, рефрактерная к терапии артериальная гипертония (АГ), эпилепсия, беременность.
Лекарственные взаимодействия: одновременный прием дулоксетина с потенциальными ингибиторами CYP1A2 (фторхинолоны) требует осторожности и снижения доз дулоксетина. Не рекомендуется применять одновременно с ингибиторами моноаминоксидазы и ТЦА.
9.1.4. Трициклические антидепрессанты
Наиболее известный ТЦА – амитриптилин; кроме него в эту группу входят имипрамин, дезипрамин, кломипрамин и нортриптилин. В течение многих десятилетий ТЦА используются для лечения хронических болевых синдромов различного генеза. В нескольких рандомизированных слепых плацебо-контролируемых клинических исследованиях было показано значительное уменьшение выраженности нейропатической боли. Последний обзор, опубликованный библиотекой Cochrane, поставил под сомнение качество результатов исследований амитриптилина, указав на небольшие размеры выборки в большинстве случаев, и заключил, что в действительности нет ни убедительных доказательств положительного влияния амитриптилина на выраженность болевого синдрома, ни доказательств отсутствия эффекта.
Амитриптилин, имипрамин и кломипрамин по химическому строению представляют собой третичные амины. ТЦА, которые относятся к вторичным аминам (нортриптилин и дезипрамин), переносятся несколько лучше, чем третичные, однако РКИ по лечению болевых синдромов этими препаратами проведено меньше и на очень небольших выборках.
Режим дозирования (на примере амитриптилина): начальная доза – 5–10 мг/сут в 2 приема. При хорошей переносимости через 3–4 дня дозу увеличивают до 10–25 мг в 2 приема, дальнейшее увеличение проводится 1 раз в 10–14 дней до достижения терапевтической дозы 50–150 мг/сут в 2–3 приема.
Основные ошибки при назначении амитриптилина:
1) назначение высоких начальных доз или быстрое увеличение дозы, в связи с чем больные отказываются от дальнейшего приема из-за побочных эффектов;
2) назначение слишком малых доз амитриптилина – от 2,5 до 25 мг/сут, которые не купируют болевой синдром, и пациенты отказываются от приема препарата из-за мнимой неэффективности.
Минимальная продолжительность тестовой терапии: не менее 3 нед в максимальной переносимой дозе.
Дополнительные положительные эффекты: антидепрессивный и противотревожный, улучшение сна.
Наиболее распространенные побочные эффекты:
1) центральные гистаминные (выраженная седация, сонливость, заторможенность, вплоть до спутанности сознания, повышение аппетита и массы тела);
2) холинолитические (спутанность сознания, делирий, когнитивная дисфункция у пожилых при длительном приеме, затруднение мочеиспускания, запоры, сухость во рту, нечеткость зрения, синусовая тахикардия, ишемия миокарда);
3) адренолитические (ортостатическая гипотония, рефлекторная тахикардия, сонливость, головокружение);
4) адренергические (отмечаются только в первые 2 нед применения: беспокойство, ощущение внутренней дрожи, тремор);
5) хинидиноподобные (удлинение интервалов PR, QRS и QT на электрокардиографии – ЭКГ, АВ-блокада и другие нарушения проводимости).
Побочные эффекты возникают не реже чем у 25–55% пациентов и являются причиной прекращения приема амитриптилина у 3–4 из каждых 100 человек.
Противопоказания: острый и ранний восстановительный период после инфаркта миокарда, острая алкогольная интоксикация, острая интоксикация снотворными, аналгезирующими и психотропными лекарственными средствами, закрытоугольная глаукома, нарушения ритма и проводимости сердца, удлинение интервала QT на ЭКГ; одновременный прием препаратов, удлиняющих интервал QT на ЭКГ; лактация, повышенная чувствительность к амитриптилину, гипертрофия предстательной железы.
С крайней осторожностью: старческий возраст, цереброваскулярная болезнь, инсульт, хроническая ишемия головного мозга любого генеза, ишемическая болезнь сердца, аритмии, сердечная недостаточность, АГ, склонность к ортостатической гипотонии, в том числе при кардиоваскулярной форме диабетической вегетативной полинейропатии, эпилепсия, сахарный диабет (нарастание гипергликемии, может потребоваться увеличение дозы сахароснижающих препаратов), хронический алкоголизм, тиреотоксикоз.
Лекарственные взаимодействия: не применять одновременно с препаратами, оказывающими угнетающее влияние на ЦНС, холинолитиками, симпатомиметиками, ингибиторами моноаминоксидазы, селективными ингибиторами обратного захвата серотонина (возможность токсических реакций), этанолом. При одновременном применении с нейролептиками взаимно угнетается метаболизм, при этом происходит снижение порога судорожной готовности. При одновременном применении с антигипертензивными средствами (за исключением клонидина, гуанетидина и их производных) возможно усиление антигипертензивного действия и риска развития ортостатической гипотензии. При одновременном применении с карбамазепином возможно уменьшение действия.
Важные правила заполнения рецептов формы 148-1/у-88:
• Отпуск всего выписанного на рецепте количества препарата осуществляется единовременно, без возможности последующего возврата рецепта пациенту.
• На 1 рецепт – 1 МНН только одной дозировки. При необходимости выписывания на курс различных дозировок препарата необходим отдельный рецепт на каждую дозировку.
• Учет рецептов в аптеке.
• В медицинскую карту пациента вносятся номер и серия рецепта.
• Исправлений в рецепте, выписанном на рецептурном бланке, не допускается.
• Рецепт заполняется разборчиво, четко, чернилами или шариковой ручкой.
• Рецепт, выписанный с нарушением установленных настоящим Порядком требований, считается недействительным.
• Допускается оформление всех реквизитов (за исключением реквизита «Подпись лечащего врача») с использованием печатающих устройств.
• Сведения о назначенном и выписанном лекарственном препарате (наименование лекарственного средства, разовая доза, способ и кратность приема или введения, длительность курса, обоснование назначенного лекарственного средства) указываются в медицинской карте пациента.
В графе «Rp» рецептурных бланков указывается:
• На латинском языке наименование лекарственного препарата (МНН, при его отсутствии – группировочное, при его отсутствии – торговое), его дозировка.
• Разрешаются только принятые правилами сокращения обозначений; твердые и сыпучие фармацевтические субстанции выписываются в граммах (0,001; 0,5; 1,0), жидкие – в миллилитрах, граммах и каплях.
• На русском или русском и национальном языках способ применения лекарственного препарата.
• Запрещается ограничиваться общими указаниями, например «внутреннее», «известно».
• Способ применения лекарственного препарата обозначается с указанием дозы, частоты, времени приема относительно сна (утром, на ночь) и его длительности, а для лекарственных препаратов, взаимодействующих с пищей, – времени их употребления относительно приема пищи (до еды, во время еды, после еды).
Рецепт, выписанный на рецептурном бланке, подписывается медицинским работником и заверяется его личной печатью (должность медицинского работника вписывать не нужно).
Дополнительно рецепт заверяется печатью медицинской организации «Для рецептов».
При выписке лекарственного препарата по решению врачебной комиссии на обороте рецептурного бланка дополнительно ставится специальная отметка («Штамп»).
Назначение и выписывание препаратов по решению врачебной комиссии производится, в частности, при первичном назначении пациенту наркотических и психотропных лекарственных препаратов списков II и III Перечня (в случае принятия руководителем медицинской организации решения о необходимости согласования назначения таких лекарственных препаратов с врачебной комиссией).
Для выписывания прегабалина, по законодательству, не требуется дополнительных согласований с администрацией лечебно-профилактического учреждения, а также решения о выписке врачебной комиссии. На рецепте ставится только подпись медицинского работника, дополнительных подписей администрации лечебно-профилактического учреждения не требуется. Для выписывания прегабалина не установлено предельно допустимой нормы на один рецепт и курс. Врач имеет право выписать любое количество капсул одной дозировки на курс на одном рецепте. Если имеется необходимость выписать сразу две дозировки препарата прегабалин, то на каждую дозировку выписывается отдельный рецепт формы 148-1/у-88.
Каратеев А.Е., Кукушкин М.Л., Чурюканов М.В., Котовская Ю.В, Маневич Т.М., Палехов А.В. Диагностика и рациональная терапия хронической боли у онкологических пациентов. Междисциплинарный консенсус экспертов. Современная Онкология. 2018; 20 (2): 5–17. DOI: 10.26442/1815-1434_2018.2.5-17
Multidisciplinary consensus of expert
Diagnosis and rational therapy of chronic pain in cancer patients
For citation: Poddubnaya I.V., Yakhno N.N., Martynov A.I. et al. Diagnosis and rational therapy of chronic pain in cancer patients. Multidisciplinary consensus of expert. Journal of Modern Oncology. 2018; 20 (2): 5–17. DOI: 10.26442/1815-1434_2018.2.5-17Состав экспертной группы
Поддубная Ирина Владимировна – акад. РАН, д-р мед. наук, проф., зав. каф. онкологии, проректор по учебной работе
и международному сотрудничеству ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Яхно Николай Николаевич – акад. РАН, д-р мед. наук, проф., проф. каф. нервных болезней лечебного фак-та, дир.
научно-образовательного клинического центра неврологии ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М.Сеченова» Минздрава России, президент Российского общества по изучению боли
Мартынов Анатолий Иванович – акад. РАН, д-р мед. наук, проф., проф. каф. госпитальной терапии №1 лечебного фак-та ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И.Евдокимова» Минздрава России, президент Российского научного медицинского общества терапевтов
Насонов Евгений Львович – акад. РАН, д-р мед. наук, проф., президент Ассоциации ревматологов России, гл. внештатный специалист-ревматолог Минздрава России
Лила Александр Михайлович – д-р мед. наук, проф., врио дир. ФГБНУ «Научно-исследовательский институт ревматологии им. В.А.Насоновой» Минздрава России
Невзорова Диана Владимировна – канд. мед. наук, зам. дир. ГБУЗ «Московский многопрофильный центр паллиативной помощи» Департамента здравоохранения г. Москвы, гл. внештатный специалист по паллиативной помощи Минздрава России, председатель правления Ассоциации профессиональных участников хосписной помощи
Абузарова Гузель Рафаиловна – д-р мед. наук, рук. Центра паллиативной помощи онкологическим больным ФГБУ «Московский научно-исследовательский онкологический институт им. П.А.Герцена» – филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России
Каратеев Андрей Евгеньевич – д-р мед. наук, зав. лаб. гастроэнтерологических проблем у пациентов с ревматологическими заболеваниями ФГБНУ «Научно-исследовательский институт ревматологии им. В.А.Насоновой» Минздрава России
Кукушкин Михаил Львович – д-р мед. наук, проф., рук. лаб. фундаментальных и прикладных проблем боли ФГБНУ «Научно-исследовательский институт общей патологии и патофизиологии» РАН, ответственный секретарь Российского общества по изучению боли
Чурюканов Максим Валерьевич – канд. мед. наук, доц. каф. нервных болезней лечебного фак-та ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М.Сеченова» Минздрава России
Котовская Юлия Викторовна – д-р мед. наук, проф., зав. лаб. сердечно-сосудистого старения Российского геронтологического научно-клинического центра
Маневич Татьяна Михайловна – канд. мед. наук, рук. Клиники боли Российского геронтологического научно-клинического центра
Палехов Александр Владимирович – рук. краевого центра паллиативной медицинской помощи взрослому населению в Ставропольском крае, гл. специалист Министерства здравоохранения Ставропольского края по противоболевой терапии, рук. курса «Паллиативная медицинская помощь» кафедры онкологии и лучевой терапии с курсом ДПО ФГБОУ ВО «Ставропольский государственный медицинский университет» Минздрава России, заслуженный врач России
Содержание
1. Введение. Общие вопросы2. Классификация показаний к лечебным вмешательствам по степени доказательной эффективности
3. Методология разработки клинических рекомендаций
4. Классификация и патогенез онкологической боли
5. Виды боли при онкологических заболеваниях: определение, терминология
6. Диагностика болевого синдрома
7. Диагностика нейропатической боли
8. Лечение онкологической боли
8.1. Фармакотерапия боли слабой интенсивности (1-я ступень)
8.2. Фармакотерапия боли умеренной интенсивности (2-я ступень)
8.3. Фармакотерапия боли выраженной интенсивности (3-я ступень)
9. Лечение нейропатической боли в онкологии
9.1. Препараты, применяемые для лечения нейропатической боли в онкологии
9.1.1. Модуляторы кальциевых каналов (габапентиноиды)
9.1.2. Антидепрессанты – ингибиторы обратного захвата моноаминов
9.1.3. Селективные ингибиторы обратного захвата серотонина и норадреналина
9.1.4. Трициклические антидепрессанты
10. Алгоритм фармакотерапии онкологической нейропатической боли
1. Введение. Общие вопросы
Около 700 тыс. человек последнего года жизни в нашей стране нуждаются в паллиативной помощи. Боль – самая распространенная причина страданий неизлечимых пациентов. Согласно определению паллиативная медицинская помощь направлена на избавление от боли и иных тяжелых проявлений неизлечимых заболеваний с целью улучшения качества жизни (№323-ФЗ «Об основах охраны здоровья граждан»). Однако в силу ряда причин проблема оказания противоболевой помощи пациентам в паллиативной медицине остается недостаточно решенной, и с назначением лекарственной терапии боли нередко возникают серьезные проблемы.
В структуре заболеваний, сопровождаемых развитием болевого синдрома, онкологические занимают первое место по частоте встречаемости боли. Последняя является одним из основных симптомов, причиняющих страдания при злокачественных новообразованиях (ЗНО). Несмотря на выдающиеся успехи, достигнутые в диагностике и терапии опухолей, по прогнозам экспертов Всемирной организации здравоохранения (ВОЗ) в ближайшем будущем заболеваемость и смертность от онкологических заболеваний будут увеличиваться, соответственно, будет расти число пациентов с болевым синдромом, обусловленным опухолевым процессом.
В России насчитывается свыше 3 млн 600 тыс. человек с установленным диагнозом ЗНО, из них ежегодно умирают около 300 тыс., и выявляется более 617 тыс. новых случаев заболевания. На начальных стадиях опухолевого процесса у 35–50% пациентов диагностируется болевой синдром, при прогрессировании ЗНО их число увеличивается до 75%, а в терминальной стадии – до 95–100%. Таким образом, число онкологических больных, нуждающихся в обезболивающей терапии, значительно превышает число умерших от ЗНО и только в нашей стране составляет более 430 тыс. пациентов [1].
В связи с этим, по мнению экспертов, представляющих ведущие российские профессиональные медицинские сообщества, назрела необходимость разработки клинических рекомендаций по диагностике и лечению болевого синдрома у онкологических пациентов. Учитывая важное обстоятельство, когда врачи различных специальностей могут быть задействованы в диагностике и терапии пациентов с болью при онкологических заболеваниях, настоящие рекомендации должны быть созданы совместными усилиями экспертов, представляющих разные медицинские специальности.
По инициативе ведущих экспертов Российского общества по изучению боли, Российского научного медицинского общества терапевтов, Ассоциации профессиональных участников хосписной помощи, Российской ассоциации геронтологов и гериатров, Ассоциации ревматологов России разработаны клинические рекомендации по диагностике и лечению хронической боли у онкологических больных.
Данный документ посвящен практическим аспектам диагностики и лечения болевого синдрома у онкологических больных. В рекомендациях изложены порядок и правила назначения обезболивающих препаратов, в том числе опиоидных анальгетиков, а также выписывания рецептов в амбулаторных и стационарных условиях. Рекомендации предназначены онкологам, специалистам по паллиативной медицинской помощи, терапевтам, врачам общей практики и врачам любых специальностей, к которым могут обратиться пациенты с онкологическими заболеваниями и болевым синдромом.
2. Классификация показаний к лечебным вмешательствам по степени доказательной эффективности
В течение последних двух десятилетий мировое сообщество использует классификацию показаний к лечебным и диагностическим вмешательствам по степени доказательной эффективности (табл. 1).
3. Методология разработки клинических рекомендаций
В клинических рекомендациях приведены правила фармакотерапии хронического болевого синдрома у онкологических пациентов с учетом перечня опиоидных анальгетиков, зарегистрированных в России. В соответствии с рекомендациями ВОЗ, а также Европейскими рекомендациями по паллиативной медицине основным методом контроля хронического болевого синдрома является фармакотерапия на основе неинвазивных форм опиоидных анальгетиков. Она применяется амбулаторно и в стационаре независимо от стадии заболевания. Полноценный контроль боли должен осуществляться на всех этапах лечения пациента, в том числе при оказании паллиативной медицинской помощи.
При подготовке клинических рекомендаций применялась современная рейтинговая оценка силы доказательств по системе GRADE. Доказательной базой для рекомендаций стали также публикации, вошедшие в библиотеку Cochrane, базы данных EMBASE и MEDLINE. Глубина поиска составила 15 лет. Для оценки качества и силы доказательств применялась таблица уровней доказательности (см. табл. 1). При формулировании рекомендаций использовался консенсус экспертов. При изложении текста рекомендаций приводятся уровни доказательности (1, 2, 3, 4), а также уровни рекомендаций (A, B, С, D).
Порядок обновления клинических рекомендаций – 1 раз в 3 года.

Клинические рекомендации будут обновляться таким образом, чтобы учесть все появляющиеся важные рекомендации в лечении хронической боли. Плановый срок их обновления – через 3 года после их утверждения. Учитывая малочисленность исследований в области лечения хронической боли у пациентов паллиативного профиля, а также отсутствие в настоящее время ряда необходимых опиоидных анальгетиков в различных формах, обновление рекомендаций в объеме пересмотра части их или документа в целом возможно в более короткие (ранние) сроки в случае опубликования новых важных фактов.
4. Классификация и патогенез онкологической боли
Хронический болевой синдром является самостоятельным заболеванием. Он не исполняет защитной функции и не несет никакой биологической целесообразности. Напротив, хроническая боль ведет к дезадаптации, ненормальному восприятию болевых и неболевых импульсов и сопровождается различными нарушениями функций центральной нервной системы (ЦНС). Клиническая картина зависит от локализации очага поражения, конституции больного, его психики и индивидуального порога болевой чувствительности, предшествующего болевого опыта [2, 3].
Основной причиной возникновения хронического болевого синдрома является длительно существующая постоянная боль, которая вызывает дисбаланс в работе периферической нервной системы и ЦНС. Нейрональные рецепторы и волокна в этом случае подвергаются постоянной активизации, что приводит к возрастающей стимуляции ЦНС (спинного и головного мозга) болевыми раздражителями. Одна из основных причин хронической боли – появление комплексов гиперреактивных нейронов на разных уровнях ЦНС. Их патологическая активность обусловлена поломкой механизмов нейронального торможения, повышенной возбудимостью нейронов и активацией неактивных синапсов, что объединяет эти нейроны в очаг возбуждения с самоподдерживающейся эктопической активностью, которая приводит к функциональным, структурным и адаптивным (нейропластическим) изменениям в головном и спинном мозге, из-за чего боль продолжается, даже когда ее причина устранена [4, 5].
Онкологическую боль классифицируют по различным критериям: временному фактору (острая, хроническая), локализации (орофациальная, тазовая, абдоминальная, боль в костях и т.д.), причине, ее вызывающей (как результат роста опухоли, противоопухолевой терапии, следствие паранеопластического синдрома, боль при конкурирующих заболеваниях).
Онкологическая боль имеет отчасти ту же природу и те же патофизиологические механизмы, какие формируются при воспалении и повреждении тканей. Общим является то, что основной причиной возникновения боли служит раздражение специфических болевых рецепторов – ноцицепторов, которые распределены в разных органах и тканях: коже, слизистых оболочках, стенках полых органов, капсулах паренхиматозных органов, а также в губчатой и минеральной составляющей костей и надкостнице.
Однако боль, вызванная злокачественным опухолевым процессом, имеет и свою специфику (табл. 2). Опухолевые клетки быстро растут, сдавливая прилежащие здоровые ткани, которые чувствительны к механическим воздействиям (висцеральные боли), либо прорастают или сдавливают периферические и центральные структуры нервной системы (нейропатическая боль). В процессе развития и роста опухоль выделяет специфические алгогены: эндотелин, простагландины и фактор некроза опухолей a, – которые возбуждают или повышают восприимчивость периферических рецепторов и нервных волокон к сенсорным раздражителям. Опухоли выделяют ионы водорода Н+, что приводит к местному ацидозу, сопровождаемому сходным эффектом. Протеолитические ферменты, вырабатываемые опухолевыми клетками, постоянно возбуждают и дестабилизируют сенсорную симпатическую иннервацию, что приводит к нейропатической боли. Боль, вызванная метастазами опухоли, возникает в результате прямого опухолевого повреждения С-афферентов сенсорных нейронов, иннервирующих костный мозг, а также из-за нарушения баланса между активностью остеокластов и остеобластов. Кости теряют прочность, подвержены остеолизу, патологическим переломам и микропереломам, в результате механическая деформация периоста становится основным источником боли [6].

5. Виды боли при онкологических заболеваниях: определение, терминология
С позиций патофизиологии различают ноцицептивную и нейропатическую боль [7, 8].
Ноцицептивная боль формируется при наличии очага повреждения в тканях (у онкологического больного при их сдавлении, прорастании опухолью) за счет раздражения периферических болевых (ноцицептивных) нервных окончаний (ноцицепторов), что сопровождается освобождением периферических болевых нейротрансмиттеров (простагландин Е2, вещество «Р» и др.), инициирующих возбуждение ноцицепторов и его распространение по афферентным нервным волокнам к нейронам задних рогов спинного мозга. На уровне спинного мозга при участии специальных болевых нейротрансмиттеров осуществляется организация восходящего ноцицептивного потока, который по спиноталамическому тракту поступает к ядрам таламуса, а затем к коре головного мозга, где происходят анализ болевой информации и формирование осознанного ощущения боли. Ноцицептивная боль носит физиологический характер, сигнализируя о неблагополучии в организме и активизируя механизмы, направленные на избавление от боли. Обращение пациента к врачу и назначение ему анальгетических средств, соответствующих интенсивности ноцицептивной боли, приводит к ее устранению. В зависимости от локализации очага боли выделяют соматическую (опорно-двигательный аппарат, кожа, мягкие ткани) и висцеральную (внутренние органы) ноцицептивную боль.
Ноцицептивная соматическая боль возникает в результате повреждения ткани или воздействия на него болезненного агента, в том числе опухоли с последующей активизацией болевых рецепторов (ноцицепторов) в костях, коже, подкожной клетчатке, мышцах и мягких тканях и пр. Эта боль хорошо локализована, может быть приходящей или постоянной, имеет различные описательные характеристики: тупая или острая, давящая, пульсирующая, дергающая, сверлящая, грызущая, распирающая и др. [9].
Ноцицептивная висцеральная боль возникает при повреждении симпатически иннервируемых органов (при поражении поджелудочной железы, стенок желудка и кишечника, растяжении капсулы печени и т.п.). Она плохо локализована, имеет разлитой характер (тупая с приступами обострения, сжимающая, схваткообразная, тянущая, изнуряющая и пр.) [9].
Нейропатическая боль имеет принципиально другое происхождение. Она возникает в результате повреждения нервной системы, которое может произойти на любом ее уровне – от рецепторов до высших отделов ЦНС. При этом нарушается функционирование как периферических, так и центральных механизмов контроля боли. При повреждении нерва повышается его возбудимость, биоэлектрические импульсы могут появляться на всем его протяжении, что вызывает боль в соответствующей зоне иннервации. В поврежденных нейронах возникает спонтанная эктопическая активность, которая вызвана активацией натриевых каналов в поврежденных регенерирующих нервных волокнах. Повышается чувствительность болевых рецепторов в результате усиленного воздействия нейротрансмиттеров (глутамат, субстанция Р и др.) на нейроны. Возникают патологические взаимодействия между нервными волокнами; импульс, идущий от нейрона с поврежденной миелиновой оболочкой, может попадать на соседний нейрон, причем становятся возможными контакты между болевыми и неболевыми сенсорными нейронами, например, передающими тактильную информацию (феномен спраутинга), что приводит к усилению и расширению зоны нейропатического болевого синдрома, извращению сенсорного восприятия. Неболевые (тактильные) импульсы начинают распознаваться как болевые, что увеличивает поток патологической болевой импульсации к нейронам заднего рога, вызывая их дальнейшее патологическое перевозбуждение. Среди центральных механизмов образования нейропатического болевого синдрома выделяют так называемый феномен взвинчивания (wind up-эффект), при котором ответ перевозбужденных нейронов на каждый последующий болевой импульс повышается даже при неизмененной силе этого импульса. Неадекватное повышение возбудимости нейронов (сенситизация) при нейропатической боли является следствием стойкой деполяризации постсинаптической мембраны нейронов ионами кальция [10–16].
Необходимым условием формирования нейропатической боли считается нарушение взаимодействия ноцицептивных (проводящих боль) и антиноцицептивных (тормозящих проведение болевых импульсов) систем с перенапряжением и последующей утратой части антиноцицептивных механизмов, т.е. возникает «дефицит торможения». При этом происходят гибель тормозных интернейронов, снижение концентрации g-аминомасляной кислоты – ГАМК (главного тормозного нейротрансмиттера ЦНС) и уменьшение плотности рецепторов ГАМК в заднем роге спинного мозга, что подавляет проведение тормозных сигналов, поступающих в нейроны заднего рога [17].
Описанные сложные механизмы развития нейропатической боли указывают на необходимость комплексной его терапии с использованием не только классических анальгетических средств, но и специальных агентов, уменьшающих перевозбуждение сенсорных нервных структур на разных уровнях, а также активизирующих механизмы, тормозящие проведение болевой информации [18].
Нейропатическая боль, согласно последним данным, является нередким симптомом и встречается примерно у каждого 3-го онкологического пациента [19].
Нейропатический болевой синдром возникает у больных со ЗНО на разных этапах развития опухолевого процесса, поскольку нервные клетки наиболее чутко реагируют на специфические изменения в организме, происходящие при прогрессировании ЗНО, а также на процессы, возникающие при проведении противоопухолевой терапии [20].
Причины этих изменений зачастую могут быть неясны, но наиболее частыми считаются непосредственное опухолевое повреждение, в том числе осложнения основного опухолевого процесса, которые сопровождаются компрессией нервных сплетений, корешков спинного мозга и нервных структур. С учетом последних исследований в этой области в среднем у 76% онкологических пациентов непосредственно опухолевое повреждение является причиной всех хронических болевых синдромов, осложнения противоопухолевой терапии вызывают боль у 11% больных, паранеопластическая и неопластическая боль регистрируется у 5% и сопутствующие коморбидные процессы – у 8%.
Если отдельно выделять наличие нейропатической боли в этой группе пациентов, то осложнения противоопухолевой терапии вдвое чаще становятся причиной возникновения нейропатической боли (табл. 3) [21].

Отдельным видом нейропатической боли в чистом виде является полинейропатия, вызванная последствиями химиотерапии высокотоксичными препаратами (таксаны, препараты платины), либо фантомная боль в результате ортопедических операций, а также лучевое повреждение нервов [22].
6. Диагностика болевого синдрома
Клиническая картина онкологической боли зависит от нескольких факторов: локализации опухоли, вовлеченности других органов и тканей в процесс, конституции больного, особенностей его психики, индивидуального порога болевой чувствительности и др. Около 40–50% больных описывают свои болевые ощущения как умеренные или выраженные, у 25–30% боль тяжелая или мучительная.
Комплексная оценка болевого синдрома играет очень важную роль в его лечении. Особое значение придается анамнезу болевого синдрома. В каждом случае необходимо выяснить характеристики боли (локализацию, интенсивность, продолжительность, факторы, облегчающие или усиливающие боль), влияние ее на качество жизни.
Для оценки интенсивности боли в качестве удобного и информативного инструмента используют визуальную аналоговую шкалу (ВАШ). Больному предлагается на шкале отметить свое восприятие боли (от минимальной до нестерпимой), что позволяет количественно выразить оценку в процентах от 0 до 100%. Вербальные ранговые шкалы представляют собой набор характеристик боли, отражающих ее интенсивность, которые устно предъявляются пациенту. Интенсивность болевого синдрома по ВАШ оценивается в процентах или баллах от 1 до 10 и интерпретируется по алгоритму, представленному в табл. 4.

Адекватную оценку боли могут затруднять разные факторы, связанные с неподготовленностью медицинского персонала и плохо собранным анамнезом боли, который должен включать следующие важные моменты:
• число и локализацию очагов боли;
• длительность предшествующего болевого анамнеза;
• эффективность предшествующей терапии боли;
• применяемые анальгетики;
• влияние боли на физическую активность;
• влияние боли на продолжительность ночного сна;
• влияние боли на возможность приема пищи и пр.
7. Диагностика нейропатической боли
Диагностика нейропатической боли должна базироваться на сочетании данных анамнеза, клинического исследования чувствительности и инструментальных данных, подтверждающих поражение структур соматосенсорной системы. Выявление нейропатической боли у пациентов должно носить активный характер и быть неотъемлемой частью сбора анамнеза с уточнением наличия и характера боли.
Нейропатическая боль имеет некоторые особенности. Прежде всего она сопровождается специфическими чувствительными расстройствами. Весьма характерной для нейропатической боли является аллодиния – появление боли в ответ на стимул, который в нормальных условиях не вызывает ее. В таких случаях больные испытывают сильные боли при малейшем прикосновении, иногда даже при дуновении ветра. Различают температурную и механическую аллодинию. Последняя подразделяется на статическую, которая появляется при давлении на фиксированную точку кожного покрова, и динамическую, возникающую при движущихся стимулах, например легком раздражении кожи кисточкой или пальцем.
При нейропатической боли часто наблюдаются гиперестезия, гипералгезия, гиперпатия, невралгия. При гипералгезии чувствительность к болевому стимулу оказывается значительно выше, чем ожидается в норме. При гиперпатии субъективный ответ как на болевой, так и неболевой стимулы является чрезмерным и часто сохраняется в течение долгого времени уже после прекращения раздражения. Пациента могут также беспокоить спонтанные боли, возникающие при очевидном отсутствии какого-либо внешнего воздействия. Они, как правило, носят жгучий, колющий характер. Чувство щекотания, безболезненного покалывания или другие подобные ощущения относятся к парестезиям; если эти ощущения причиняют боль, то их называют дизестезиями.
Примером аллодинии могут служить фантомный, пост-торакотомический или постмастэктомический синдромы, когда спустя даже длительное время после оперативного вмешательства у некоторых больных отмечается резкая болезненность или невыносимое жжение в области послеоперационной раны, которые могут возникать даже от легкого касания кожи носимой одеждой, при этом более сильное надавливание в этой зоне не вызывает подобной болевой реакции.
Боли нейропатической природы могут возникать спонтанно, без какой-либо видимой причины, при этом они имеют простреливающий, «как удар электротоком», или жгучий характер, способны усиливаться при психоэмоциональных переживаниях и под влиянием индифферентных раздражителей. Такими бывают постампутационные фантомные боли после хирургического пересечения нервных стволов, если не проводились мероприятия по профилактике фантомного болевого синдрома.
Одним из наиболее тяжелых вариантов нейропатической боли является каузалгия, или так называемая симпатически усиленная боль, развивающаяся вследствие нарушения периферической иннервации в периферических ноцицептивных и постганглионарных симпатических волокнах (после операции или при росте опухоли). При этом описанные выше сенсорные расстройства сочетаются с признаками гиперактивности тканей, иннервируемых симпатическими нервами. Они выражаются в вазомоторных реакциях (локальная гиперемия или бледность кожи), трофических изменениях тканей, гипергидрозе (например, при рецидиве опухоли в зоне удаленной молочной железы). Каузалгия особенно трудно поддается терапии.
Для облегчения идентификации нейропатической боли были разработаны скрининговые шкалы: Leeds Assesment of Neuropathic Symptoms and Signs – LANSS (Лидская шкала оценки нейропатических симптомов и признаков), Douleur Neuropathic 4 – DN4 (диагностический опросник нейропатической боли), Pain DETECT, Neuropathic Pain Questionnaire (опросник нейропатической боли), ID Pain и др. Каждая шкала характеризует нейропатическую боль путем наличия позитивных и негативных симптомов и знаков, включающих спонтанную боль, парестезии, дизестезии, аллодинию, двигательный и чувствительный дефект. Учитывая важность определения наличия нейропатической боли для дальнейшего лечения, обязательны надежность, валидность и диагностическая точность подобных шкал. Опросники Pain DETECT и Standardized Evaluation of Pain – StEP (стандартизированная оценка боли) позволяют дифференцировать нейропатический и ненейропатический характер боли на основе вербальных дескрипторов с ограниченным клиническим обследованием или без такового.
 В настоящее время одним из самых чувствительных в отношении выявления нейропатической боли является опросник DN4 (рис. 1).
В настоящее время одним из самых чувствительных в отношении выявления нейропатической боли является опросник DN4 (рис. 1).При положительном ответе на 4 и более вопросов из 10 пунктов этого опросника диагноз «нейропатическая боль» становится обоснованным. Чувствительность методики DN4 (число пациентов с нейропатической болью, у которых выявляется эта патология по результатам тестирования) составляет 80%, что позволяет использовать ее в качестве скрининга для выявления нейропатических болевых синдромов. При этом специфичность опросника не столь высока.
Данные количественного сенсорного тестирования с использованием контролируемых физиологических стимулов, таких как температура, давление, укол и вибрация, используются для точной верификации чувствительных нарушений при нейропатической боли. Изменения по данным соматосенсорных и лазерных вызванных потенциалов характерны для нейропатической боли, но имеют ограниченное диагностическое значение. Количественное сенсорное тестирование и нейрофизиологические данные могут быть использованы у пациентов с нейропатической болью, когда поражение трудно зафиксировать по данным клинического обследования, для исключения других причин боли и изучения механизмов развития болевого синдрома.
Указанные сенсорные расстройства значительно утяжеляют течение болевого синдрома у пациентов с онкологическими заболеваниями, нарушают сон и психологическое состояние, приводят к развитию депрессии, частота которой при нейропатической боли достигает 80% по сравнению с 10–12% при ноцицептивном болевом синдроме. Депрессия, в свою очередь, способствует усилению болевого синдрома и затрудняет его терапию. Поэтому лечение нейропатической боли должно быть начато как можно раньше.
Дифференциальная диагностика типов боли, оценка предыдущего и настоящего лечения и их побочных эффектов и осложнений позволяют найти наилучшую безопасную и эффективную комбинацию анальгетиков, добиться наиболее высокого качества жизни пациента при минимуме препаратов и побочных эффектов (рис. 2).
8. Лечение онкологической боли
Терапия болевых синдромов в онкологической клинике – это сложная, но в большинстве случаев решаемая проблема при условии правильной диагностики типа и причины возникновения боли. Главным методом лечения хронического болевого синдрома у онкологического больного является фармакотерапия, осуществляемая на основе ступенчатого принципа, рекомендованного ВОЗ.
ВОЗ предложила трехступенчатую лестницу обезболивания (рис. 3) [23], важнейшим условием использования которой является необходимость оценки интенсивности боли, проведенной самим пациентом, а анальгетики разделены на неопиоидные и опиоидные (слабые и сильные), причем в каждой группе определены основные и альтернативные препараты. ВОЗ включила опиоидные анальгетики в трехступенчатую схему терапии неонкологической боли, когда физиотерапия, массажи и лечение другими анальгетическими препаратами (парацетамол, нестероидные противовоспалительные препараты – НПВП, трициклические антидепрессанты – ТЦА, антиконвульсанты) не могут обеспечить достаточный контроль над болью и качеством жизни больного. Исследовательский отдел Европейской Ассоциации по Паллиативной помощи (ЕАПП) в 2012 г. провел научную оценку рекомендаций ВОЗ в части использования опиоидов на основе современных методов доказательной медицины по системе GRADE и опубликовал свои рекомендации под названием «Использование опиоидных анальгетиков для обезболивания при злокачественных новообразованиях: доказательные рекомендации ЕАПП», где были пересмотрены и уточнены некоторые положения фармакотерапии онкологической боли, провозглашенные ВОЗ в 1996 г. В качестве препаратов для лечения умеренной боли рекомендовано использовать не только слабые, но и сильные опиоиды в низких дозировках.

Основные принципы обезболивания:
• дозы анальгетика подбираются начиная с высоких дозировок слабых препаратов с переходом к низким дозам более сильных [24, 25];
• необязательно последовательно идти от одной ступени к другой: пациент с тяжелым болевым синдромом сразу может нуждаться в сильных опиоидных анальгетиках;
• переход с одной ступени обезболивания на следующую определяется усилением боли, недостаточным ответом на применяемую обезболивающую терапию и побочными эффектами лекарственных препаратов у конкретного пациента (табл. 5).


8.1. Фармакотерапия боли слабой интенсивности (1-я ступень)
Неопиоидные анальгетики ± адъювантная терапия
Особенностью данного этапа является слабая интенсивность боли на уровне 0–40% по ВАШ. Характерна высокая эффективность неопиоидных анальгетиков. Основные препараты терапии – парацетамол и НПВП (табл. 6).НПВП играют важную роль в анальгетической терапии при онкологических заболеваниях [26]. В ряде случаев (при умеренно выраженной боли) они могут использоваться как монотерапия, но наиболее часто их применяют в комплексе с опиоидными анальгетиками. По данным РКИ [27–31] и соответствующего метаанализа, включавшего данные 42 РКИ (n=3084), при онкологической боли НПВП достоверно превосходят плацебо. В недавно опубликованных 11 РКИ разного типа, включая открытые (n=949), было продемонстрировано снижение боли с высокой до умеренной у 26–51% больных, получавших НПВП [32].
Данные о повышении эффективности обезболивания при комбинации НПВП и опиоидов носят противоречивый характер. Так, из 14 РКИ, в которых изучали этот вопрос, в 5 не отмечено различия между комбинированной терапией и монотерапией опиоидами, а в 9 показано статистически достоверное (хотя и небольшое) преимущество комбинации НПВП и опиоидов [33].
Имеются ограниченные данные, демонстрирующие дополнительное благоприятное действие НПВП у больных с поздними стадиями онкологических заболеваний на фоне раковой кахексии: улучшение качества жизни и внешнего вида, повышение массы тела [34].
Выбор НПВП должен проводиться с учетом возможных рисков развития неблагоприятных реакций, характерных для этих препаратов, а также рисков проводимого противоопухолевого лечения (табл. 7).

8.2. Фармакотерапия боли умеренной интенсивности (2-я ступень)
Слабые опиоидные + неопиоидные анальгетики ± адъювантная терапия
Особенностью данного этапа является интенсивность боли на уровне 40–70% по ВАШ. Продолжительность предшествующего болевого синдрома составляет, как правило, 2–3 мес, но встречаются и болевые состояния длительностью менее 1–2 нед. При неэффективности препаратов, предназначенных для терапии слабой боли, следует перейти к назначению лекарственных препаратов, относящихся к группе слабых опиоидных анальгетиков, среди которых препаратом 1-й линии является трамадол, а при плохой переносимости или противопоказаниях к его использованию – Просидол или низкие дозы сильных опиоидов: тапентадола (до 200 мг/сут), трансдермальной терапевтической системы (ТТС) фентанила (12,5 мкг/ч), оксикодона (до 20 мг/сут перорально), морфина до 30 мг/сут перорально. В качестве адъювантных анальгетиков могут дополнительно применяться анальгетики 1-й ступени, а также кортикостероиды, спазмолитики, миорелаксанты, антиконвульсанты, антидепрессанты. В случае невозможности применения пероральных, защечных (трансмукозальных), трансдермальных форм препаратов рекомендуется назначать парентеральное (подкожное) введение морфина (табл. 8, 9).8.3. Фармакотерапия боли выраженной интенсивности (3-я ступень)

Сильные опиоидные + неопиоидные анальгетики ± адъювантная терапия
При сильных болевых синдромах интенсивность боли составляет более 70% по ВАШ, эффективность высоких доз трамадола или его комбинации с НПВП недостаточна. Недостаточен эффект Просидола или низких доз сильных опиоидов в сочетании с адъювантными препаратами.В этих случаях назначаются сильнодействующие опиоидные анальгетики (тапентадол, оксикодон, морфин, фентанил) либо высокие дозы Просидола (непродолжительно) как переходного анальгетика (табл. 10, 11).
9. Лечение нейропатической боли в онкологии
У онкологических больных нейропатическая боль чаще всего имеет сочетанный характер и возникает как компонент уже имеющегося висцерального или соматического болевого синдрома, по поводу которого пациенты, как правило, получают опиоидные и неопиоидные анальгетики, однако эти препараты только частично ослабляют проявления нейропатии, поскольку не способны воздействовать на ее причины. В этих случаях противоболевая терапия должна быть комплексной, и анальгетики, блокирующие ноцицептивную (висцеральную и соматическую) боль, должны быть дополнены специальными препаратами для лечения нейропатической боли.


Основными средствами для лечения нейропатической боли любого, в том числе и онкологического генеза, являются препараты из группы антидепрессантов (амитриптилин, дулоксетин, венлафаксин) или антиконвульсантов (карбамазепин, габапентин, прегабалин) [36] (рис. 4).
Эффективность этих препаратов объясняется патогенезом нейропатической боли. ТЦА угнетают обратный захват серотонина и норадреналина в пресинаптических нейронах, активизируя тем самым нисходящее торможение на процесс боли. Кроме того, препараты этой группы в некоторой степени блокируют натриевые каналы периферических нервов и являются антагонистами NMDA-рецепторов, участвующих в процессе формирования боли.
Антиконвульсанты, изначально применяемые при эпилепсии, также показали себя эффективными средствами при нейропатической боли. Антиконвульсанты I поколения (фенитоин, карбамазепин и др.) демонстрируют анальгетический эффект за счет блокирования натриевых и кальциевых каналов периферических нервов; препараты II поколения (габапентин, прегабалин) тормозят высвобождение нейротрансмиттеров – медиаторов боли (глутамат, субстанция Р, норадреналин) и замедляют передачу нервного импульса [37].
Среди антиконвульсантов наиболее эффективными препаратами для лечения нейропатической боли считаются габапентин и прегабалин, которые являются препаратами 1-й линии во всех ведущих рекомендациях по лечению нейропатической боли неврологических и онкологических сообществ Европы и США, включая рекомендации неврологов и онкологов России.
Эффективность прегабалина и габапентина подтверждена международными рандомизированными клиническими исследованиями, в том числе при лечении нейропатической боли у онкологических пациентов, принимающих опиаты. Прегабалин доказал свою эффективность у онкологических больных при периферической нейропатии, индуцированной химиотерапией. В проведенном исследовании наибольшую эффективность по сравнению с опиоидами, НПВП и карбамазепином показал прегабалин [38].

9.1. Препараты, применяемые для лечения нейропатической боли в онкологии
9.1.1. Модуляторы кальциевых каналов (габапентиноиды)
В эту группу входят два препарата с близким строением молекулы – габапентин и прегабалин. Они являются производными ГАМК (англ. аббревиатура GABA, откуда и образовалось название группы «габапентиноиды»). Препараты этой группы связываются не с рецепторами ГАМК, а с a2d-субъединицей потенциалзависимых кальциевых каналов нейронов, что вызывает уменьшение поступления ионов Ca2+ в пресинаптические окончания нейронов, находящихся в состоянии гипервозбуждения. Это ведет к торможению выхода возбуждающих нейромедиаторов в синаптическую щель и замедлению передачи нервного импульса на следующий нейрон. Габапентиноиды действуют только на «перевозбужденные» нейроны в заднем роге спинного мозга и ЦНС и не влияют на нормально функционирующие нейроны.
Габапентин – первый габапентиноид, внедренный в клиническую практику.
Режим дозирования: начальная доза 300 мг 1 раз в сутки, на 2-й день – 300 мг 2 раза в сутки, на 3-й – 300 мг 3 раза в сутки. В дальнейшем дозировку постепенно увеличивают до достижения эффекта, возможно, до 1800–3600 мг/сут.
В 2017 г. в Российской Федерации была зарегистрирована новая дозировка препарата 600 мг таблетка с риской.
Минимальная продолжительность тестовой терапии составляет от 3 до 8 нед титрования дозы плюс не менее
2 нед приема в максимальной переносимой дозе.
Дополнительные положительные эффекты: противотревожный, седативный.
Наиболее частые побочные эффекты: сонливость, головокружение, атаксия, слабость, периферические отеки. Они могут быть более выраженными у пациентов пожилого и старческого возраста.
Основные противопоказания: повышенная чувствительность к препарату, беременность и лактация, дети до 17 лет.
Меры предосторожности: пациентам с нарушениями функции почек, а также больным, находящимся на гемодиализе, требуется коррекция режима дозирования.
Лекарственные взаимодействия: практически отсутствуют. Антациды уменьшают всасывание габапентина из желудочно-кишечного тракта.
Прегабалин является самым изученным антиконвульсантом в лечении нейропатической боли. Его молекула представляет собой модифицированную молекулу габапентина. Сродство молекулы прегабалина к a2d-субъединице Ca2+ канала в 6 раз выше, чем габапентина, а всасывание является линейным и зависит от дозы, что также в положительную сторону отличает прегабалин от габапентина.
В связи с этими особенностями фармакокинетики обезболивающий эффект наступает раньше, чем у габапентина, длительный период подбора дозы не требуется.
Режим дозирования: начальная доза – 25–75 мг 1–2 раза в сутки, с 3 по 7-й день – по 150 мг 2 раза в сутки, далее при необходимости – по 300 мг 2 раза в сутки.
Минимальная продолжительность тестовой терапии: 2–4 нед в максимальной переносимой дозировке.
Дополнительные положительные эффекты: стойкое улучшение сна и уменьшение хронической патологической тревоги, часто сопутствующей болевому синдрому.
Наиболее частые побочные эффекты: головокружение (21–46% больных), сонливость (14–46%), эйфория; реже – периферические отеки, прибавка массы тела, слабость, головная боль, сухость во рту, атаксия. Обычно головокружение и сонливость возникают в 1 или 2-й день приема препарата и проходят через 6–17 дней (головокружение) или 26–31 день (сонливость), о чем следует предупредить больного заранее. Из-за плохой переносимости от приема доз 150–300 мг/сут отказываются 2,6 и 2,1% больных, соответственно, от приема дозы 600 мг/сут – до 28%. Как и при приеме любых психотропных средств, побочные эффекты чаще проявляются у пациентов преклонного возраста, которым в связи с этим требуется назначать препарат в меньшей начальной дозе и титровать дозировки медленнее.
Основные противопоказания: повышенная чувствительность к препарату, беременность и лактация, дети до 17 лет.
Меры предосторожности: с осторожностью – при отеках (сердечная, почечная недостаточность).
Лекарственные взаимодействия: возможно усиление эффекта седативных препаратов.
9.1.2. Антидепрессанты – ингибиторы обратного захвата моноаминов
Препараты, ингибирующие обратный захват моноаминов (серотонина и норадреналина), повышают концентрацию этих нейротрансмиттеров в синаптической щели и оказывают непосредственное влияние на ингибирующую активность нисходящих нейронов, влияя на центральные механизмы болевой перцепции. Их обезболивающий эффект не зависит от антидепрессивного.
В эту группу относят селективный ингибитор обратного захвата серотонина и норадреналина дулоксетин и ТЦА.
В связи с тем, что ТЦА не являются селективными препаратами, они помимо моноаминов действуют на центральные гистаминовые рецепторы, а также обладают холинолитическим, a-адреноблокирующим и b-адреностимулирующим и хинидиноподобным эффектами, что определяет их худшую переносимость и большее число противопоказаний, чем у селективных ингибиторов обратного захвата серотонина и норадреналина.
9.1.3. Селективные ингибиторы обратного захвата серотонина и норадреналина
Дулоксетин
Режим дозирования: начальная доза – 60 мг 1 раз в сутки, эффективные обезболивающие дозы – 60 и 90 мг 1 раз в сутки и 120 мг/сут в 2 приема. В связи с тем, что в первые 1–2 нед использования дозы 60 мг у некоторых пациентов может появляться тревога, которая проявляется нарушением сна, тахикардией или легкой тошнотой («норадреналиновые эффекты»), можно начинать прием с 30 мг/сут с увеличением дозы до 60 мг через неделю. Альтернативой является комбинация 60 мг дулоксетина с небольшими дозами любого седативного препарата (валерианы 2–3 таблетки в сутки; тофизопама 50 мг 2 раза в сутки; гидроксизина 12,5–25 мг/сут в 1 или 2 приема; тиаприда 50 мг 2 раза в сутки; феназепама 0,025 мг 1–2 раза в сутки и т.д.). Через 2–3 нед противотревожный препарат отменяют, а прием дулоксетина продолжают.
Минимальная продолжительность тестовой терапии: не менее 4 нед в максимальной переносимой дозе. У большинства пациентов уменьшение болевого синдрома отмечается уже в первые дни приема препарата.
Дополнительные положительные эффекты: доказанное улучшение качества жизни, нарушенного в связи с болевой диабетической периферической нейропатией, антидепрессивный эффект.
Наиболее распространенные побочные эффекты: на дозе 60 мг – нарушения сна (трудности засыпания или сонливость), легкая тошнота, тахикардия, склонность к запорам; на более высоких дозах – сухость во рту, потливость, усиление или, чаще, снижение аппетита. Из-за побочных эффектов от приема препарата в дозе 60 мг/сут отказываются 4–10% больных, 120 мг/сут – 12–19%. В плацебо-контролируемых исследованиях дулоксетин не повышал уровень гликированного гемоглобина у больных сахарным диабетом; клинически незначимое повышение (разница 0,33% с контрольной группой) отмечалось лишь в одном долгосрочном исследовании. У пожилых пациентов побочные эффекты способны проявляться сильнее, их выраженность можно уменьшить назначением меньших начальных доз и более медленным титрованием.
Противопоказания: декомпенсированная закрытоугольная глаукома, повышенная чувствительность к препарату, лактация.
С предосторожностью: печеночная недостаточность, почечная недостаточность со скоростью клубочковой фильтрации менее 30 мл/мин, рефрактерная к терапии артериальная гипертония (АГ), эпилепсия, беременность.
Лекарственные взаимодействия: одновременный прием дулоксетина с потенциальными ингибиторами CYP1A2 (фторхинолоны) требует осторожности и снижения доз дулоксетина. Не рекомендуется применять одновременно с ингибиторами моноаминоксидазы и ТЦА.
9.1.4. Трициклические антидепрессанты
Наиболее известный ТЦА – амитриптилин; кроме него в эту группу входят имипрамин, дезипрамин, кломипрамин и нортриптилин. В течение многих десятилетий ТЦА используются для лечения хронических болевых синдромов различного генеза. В нескольких рандомизированных слепых плацебо-контролируемых клинических исследованиях было показано значительное уменьшение выраженности нейропатической боли. Последний обзор, опубликованный библиотекой Cochrane, поставил под сомнение качество результатов исследований амитриптилина, указав на небольшие размеры выборки в большинстве случаев, и заключил, что в действительности нет ни убедительных доказательств положительного влияния амитриптилина на выраженность болевого синдрома, ни доказательств отсутствия эффекта.
Амитриптилин, имипрамин и кломипрамин по химическому строению представляют собой третичные амины. ТЦА, которые относятся к вторичным аминам (нортриптилин и дезипрамин), переносятся несколько лучше, чем третичные, однако РКИ по лечению болевых синдромов этими препаратами проведено меньше и на очень небольших выборках.
Режим дозирования (на примере амитриптилина): начальная доза – 5–10 мг/сут в 2 приема. При хорошей переносимости через 3–4 дня дозу увеличивают до 10–25 мг в 2 приема, дальнейшее увеличение проводится 1 раз в 10–14 дней до достижения терапевтической дозы 50–150 мг/сут в 2–3 приема.
Основные ошибки при назначении амитриптилина:
1) назначение высоких начальных доз или быстрое увеличение дозы, в связи с чем больные отказываются от дальнейшего приема из-за побочных эффектов;
2) назначение слишком малых доз амитриптилина – от 2,5 до 25 мг/сут, которые не купируют болевой синдром, и пациенты отказываются от приема препарата из-за мнимой неэффективности.
Минимальная продолжительность тестовой терапии: не менее 3 нед в максимальной переносимой дозе.
Дополнительные положительные эффекты: антидепрессивный и противотревожный, улучшение сна.
Наиболее распространенные побочные эффекты:
1) центральные гистаминные (выраженная седация, сонливость, заторможенность, вплоть до спутанности сознания, повышение аппетита и массы тела);
2) холинолитические (спутанность сознания, делирий, когнитивная дисфункция у пожилых при длительном приеме, затруднение мочеиспускания, запоры, сухость во рту, нечеткость зрения, синусовая тахикардия, ишемия миокарда);
3) адренолитические (ортостатическая гипотония, рефлекторная тахикардия, сонливость, головокружение);
4) адренергические (отмечаются только в первые 2 нед применения: беспокойство, ощущение внутренней дрожи, тремор);
5) хинидиноподобные (удлинение интервалов PR, QRS и QT на электрокардиографии – ЭКГ, АВ-блокада и другие нарушения проводимости).
Побочные эффекты возникают не реже чем у 25–55% пациентов и являются причиной прекращения приема амитриптилина у 3–4 из каждых 100 человек.
Противопоказания: острый и ранний восстановительный период после инфаркта миокарда, острая алкогольная интоксикация, острая интоксикация снотворными, аналгезирующими и психотропными лекарственными средствами, закрытоугольная глаукома, нарушения ритма и проводимости сердца, удлинение интервала QT на ЭКГ; одновременный прием препаратов, удлиняющих интервал QT на ЭКГ; лактация, повышенная чувствительность к амитриптилину, гипертрофия предстательной железы.
С крайней осторожностью: старческий возраст, цереброваскулярная болезнь, инсульт, хроническая ишемия головного мозга любого генеза, ишемическая болезнь сердца, аритмии, сердечная недостаточность, АГ, склонность к ортостатической гипотонии, в том числе при кардиоваскулярной форме диабетической вегетативной полинейропатии, эпилепсия, сахарный диабет (нарастание гипергликемии, может потребоваться увеличение дозы сахароснижающих препаратов), хронический алкоголизм, тиреотоксикоз.
Лекарственные взаимодействия: не применять одновременно с препаратами, оказывающими угнетающее влияние на ЦНС, холинолитиками, симпатомиметиками, ингибиторами моноаминоксидазы, селективными ингибиторами обратного захвата серотонина (возможность токсических реакций), этанолом. При одновременном применении с нейролептиками взаимно угнетается метаболизм, при этом происходит снижение порога судорожной готовности. При одновременном применении с антигипертензивными средствами (за исключением клонидина, гуанетидина и их производных) возможно усиление антигипертензивного действия и риска развития ортостатической гипотензии. При одновременном применении с карбамазепином возможно уменьшение действия.
Правила выписывания препаратов на рецептурном бланке 148у
Согласно приказу Министерства здравоохранения Российской Федерации от 22 апреля 2014 года №183н «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно-количественному учету» лекарственный препарат прегабалин включен в перечень препаратов, подлежащих предметно-количественному учету (ПКУ), раздел IV «Иные лекарственные средства, подлежащие предметно-количественному учету» [39]. Прегабалин выписывается на рецептурных бланках формы 148-1/у-88 (приказ Минздрава РФ от 20 декабря 2012 г. №1175н «Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения») [40].Важные правила заполнения рецептов формы 148-1/у-88:
• Отпуск всего выписанного на рецепте количества препарата осуществляется единовременно, без возможности последующего возврата рецепта пациенту.
• На 1 рецепт – 1 МНН только одной дозировки. При необходимости выписывания на курс различных дозировок препарата необходим отдельный рецепт на каждую дозировку.
• Учет рецептов в аптеке.
• В медицинскую карту пациента вносятся номер и серия рецепта.
• Исправлений в рецепте, выписанном на рецептурном бланке, не допускается.
• Рецепт заполняется разборчиво, четко, чернилами или шариковой ручкой.
• Рецепт, выписанный с нарушением установленных настоящим Порядком требований, считается недействительным.
• Допускается оформление всех реквизитов (за исключением реквизита «Подпись лечащего врача») с использованием печатающих устройств.
• Сведения о назначенном и выписанном лекарственном препарате (наименование лекарственного средства, разовая доза, способ и кратность приема или введения, длительность курса, обоснование назначенного лекарственного средства) указываются в медицинской карте пациента.
В графе «Rp» рецептурных бланков указывается:
• На латинском языке наименование лекарственного препарата (МНН, при его отсутствии – группировочное, при его отсутствии – торговое), его дозировка.
• Разрешаются только принятые правилами сокращения обозначений; твердые и сыпучие фармацевтические субстанции выписываются в граммах (0,001; 0,5; 1,0), жидкие – в миллилитрах, граммах и каплях.
• На русском или русском и национальном языках способ применения лекарственного препарата.
• Запрещается ограничиваться общими указаниями, например «внутреннее», «известно».
• Способ применения лекарственного препарата обозначается с указанием дозы, частоты, времени приема относительно сна (утром, на ночь) и его длительности, а для лекарственных препаратов, взаимодействующих с пищей, – времени их употребления относительно приема пищи (до еды, во время еды, после еды).
Печати на бланке рецепта
В левом верхнем углу проставляется штамп медицинской организации с указанием ее наименования, адреса и телефона (это очень важный реквизит, так как у фармацевта должна быть обеспечена связь с лечебно-профилактическим учреждением в случае неправильно выписанного рецепта).Рецепт, выписанный на рецептурном бланке, подписывается медицинским работником и заверяется его личной печатью (должность медицинского работника вписывать не нужно).
Дополнительно рецепт заверяется печатью медицинской организации «Для рецептов».
При выписке лекарственного препарата по решению врачебной комиссии на обороте рецептурного бланка дополнительно ставится специальная отметка («Штамп»).
Назначение и выписывание препаратов по решению врачебной комиссии производится, в частности, при первичном назначении пациенту наркотических и психотропных лекарственных препаратов списков II и III Перечня (в случае принятия руководителем медицинской организации решения о необходимости согласования назначения таких лекарственных препаратов с врачебной комиссией).
Для выписывания прегабалина, по законодательству, не требуется дополнительных согласований с администрацией лечебно-профилактического учреждения, а также решения о выписке врачебной комиссии. На рецепте ставится только подпись медицинского работника, дополнительных подписей администрации лечебно-профилактического учреждения не требуется. Для выписывания прегабалина не установлено предельно допустимой нормы на один рецепт и курс. Врач имеет право выписать любое количество капсул одной дозировки на курс на одном рецепте. Если имеется необходимость выписать сразу две дозировки препарата прегабалин, то на каждую дозировку выписывается отдельный рецепт формы 148-1/у-88.
Список исп. литературыСкрыть список1. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2016 году (заболеваемость и смертность) М.: МНИОИ им. П.А.Герцена – филиал ФГБУ «НМИЦ Радиологии» Минздрава России, 2018; 249 с. / Kaprin A.D., Starinskij V.V., Petrova G.V. Zlokachestvennye novoobrazovaniya v Rossii v 2016 godu (zabolevaemost i smertnost) M.: MNIOI im. P.A.Gercena – filial FGBU «NMIC Radiologii» Minzdrava Rossii, 2018. [in Russian]
2. Артеменко А.Р., Вейн А.М., Вознесенская Т.Г. и др. Болевые синдромы в неврологической практике. 3-е изд., перераб. и доп. М.: МЕДпресс-информ, 2010. / Artemenko A.R., Vejn A.M., Voznesenskaya T.G. i dr. Bolevye sindromy v nevrologicheskoj praktike. 3-e izd., pererab. i dop. M.: MEDpress-inform, 2010. [in Russian]
3. Данилов А.Б., Данилов Ал.Б. Управление болью. Биопсихосоциальный подход. М.: АММ-Пресс, 2012. / Danilov A.B., Danilov Al.B. Upravlenie bol'yu. Biopsihosocial'nyj podhod. M.: AMM-Press, 2012. [in Russian]
4. Данилов А.Б., Данилов Ал.Б. Биопсихосоциокультурная модель и хроническая боль. Совр. терапия в психиатрии и неврологии. 2013; 1: 30–6. / Danilov A.B., Danilov Al.B. Biopsihosociokul'turnaya model' i hronicheskaya bol'. Sovr. terapiya v psihiatrii i nevrologii. 2013; 1: 30–6. [in Russian]
5. Крыжановский Г.Н. Центральные патофизиологические механизмы патологической боли. Тезисы докладов научно-практической конференции с международным участием «Клинические и теоретические аспекты боли». М., 2001; с. 14. / Kryzhanovskij G.N. Central'nye patofiziologicheskie mekhanizmy patologicheskoj boli. Tezisy dokladov nauchno-prakticheskoj konferencii s mezhdunarodnym uchastiem "Klinicheskie i teoreticheskie aspekty boli". M., 2001; s. 14. [in Russian]
6. Paice JA, Bell RF, Kalso EA, Soyannwo OA. Cancer Pain. From Molecules to Saffering. IASP Press. Seattle, 2010.
7. Болевые синдромы в неврологической практике. Под ред. А.М.Вейна, М., 2001. / Bolevye sindromy v nevrologicheskoj praktike. Pod red. A.M.Vejna, M., 2001. [in Russian]
8. Hansson P, Fields H, Hill R, Marchettini P (eds). Neuropathic Pain: Pathophysiology and Treatment, Progress in Pain Research and Management. Seattle, WA: IASP Press, 2001; 21: 151–67.
9. Каприн А.Д., Абузарова Г.Р., Хороненко В.Э. и др. Фармакотерапия хронического болевого синдрома у онкологических пациентов. М.: МНИОИ им. П.А.Герцена – филиал ФГБУ «ФМИЦ им. П.А.Герцена» Минздрава России, 2015. / Kaprin A.D., Abuzarova G.R., Horonenko V.E. i dr. Farmakoterapiya hronicheskogo bolevogo sindroma u onkologicheskih pacientov. M.: MNIOI im. P.A.Gercena – filial FGBU "FMIC im. P.A.Gercena" Minzdrava Rossii, 2015. [in Russian]
10. Данилов А.Б. Габапентин (нейронтин) в лечении нейропатической боли. Клин.. фармакология и терапия. 2004; 13 (4): 57–60. / Danilov A.B. Gabapentin (nejrontin) v lechenii nejropaticheskoj boli. Klin.. farmakologiya i terapiya. 2004; 13 (4): 57–60. [in Russian]
11. Данилов А.Б. Нейропатическая боль. М.: Нейромедиа, 2003. / Danilov A.B. Nejropaticheskaya bol'. M.: Nejromedia, 2003. [in Russian]
12. Кукушкин М.Л. Патофизиологические механизмы болевых синдромов. Боль. 2003; 1: 5–16. / Kukushkin M.L. Patofiziologicheskie mekhanizmy bolevyh sindromov. Bol'. 2003; 1: 5–16. [in Russian]
13. Attal N. Chronic neuropathic pain: mechanisms and treatment. Clin
J Pain 2000; 16: S118–S130.
14. Chapman C, Gavrin J. Suffering: the contributions of persistent pain. Lancet 1999; 353 (9171): 2233–7.
15. Gureje O, Von Korff M, Simon G, Gater R. Persistent pain and well-being: a World Health Organization study in primary care. JAMA 1998; 280 (2): 147–51.
16. Harden R. Gabapentin: a new tool in the treatment of neuropathic pain. Acta Neurol Scand 1999; 173 (Suppl. 100): 43–7.
17. Hansson PT, Fields HL, Hill RG, Marchettini R. Neuropathic pain: pathophysiology and treatment. Progress in pain research and management. IASP Press, Seattle, 2001. Vol. 21.
18. Woolf C, Mannion R. Neuropathic pain: aetiology symptoms, mechanisms and management. Lancet 2001; 357 (Suppl. 1): 1959–64.
19. Штрибель Х.В. Терапия хронической боли. Практическое руководство. М.: ГЭОТАР-Медиа, 2005. / Shtribel' H.V. Terapiya hronicheskoj boli. Prakticheskoe rukovodstvo. M.: GEOTAR-Media, 2005. [in Russian]
20. Bennett MI, Rayment C, Hjermstad M et al. Prevalence and etiology of neuropathic pain in cancer patients: a systematic review. Pain 2012; 153: 359–65.
21. Identification and treatment of neuropathic pain in patients with cancer. IASP, Pain: Clinical Updates Vol. XX. Issue 2. Available at: http://www.iasp-pain.org
22. Fallon MT. Neuropathic pain in cancer. Br J Anaesth 2013; 111 (1): 105–11.
23. Glossary of Globalization, Trade and Health Terms of the World Health Organization. http://www.who.int/trade/glossary/en/
24. Use of Opioid Analgesics in the Treatment of Cancer Pain: Evidence-based Recommendations from the EAPC. Lancet Oncol 2012; 13: e58–e68.
25. Gourlay GK, Cherry DA, Cousins MJ. A comparative study of the efficacy and pharmacokinetics of oral methadone and morphine in the treatment of severe pain in patients with cancer. Pain 1986; 25 (3): 297–312.
26. Vardy J, Agar M. Nonopioid drugs in the treatment of cancer pain.
J Clin Oncol 2014; 32 (16): 1677–90. DOI: 10.1200/JCO.2013. 52.8356
27. Rodríguez MJ, Contreras D, Gálvez R et al. Double-blind evaluation of short-term analgesic efficacy of orally administered dexketoprofen trometamol and ketorolac in bone cancer pain. Pain 2003; 104 (1–2): 103–10.
28. Mercadante S, Fulfaro F, Casuccio A. A randomised controlled study on the use of anti-inflammatory drugs in patients with cancer pain on morphine therapy: effects on dose-escalation and a pharmacoeconomic analysis. Eur J Cancer 2002; 38 (10): 1358–63.
29. Pannuti F, Robustelli della Cuna G, Ventaffrida V et al. A double-blind evaluation of the analgesic efficacy and toxicity of oral ketorolac and diclofenac in cancer pain. The TD/10 recordati Protocol Study Group. Tumori 1999; 85 (2): 96–100.
30. Liu Z, Xu Y, Liu ZL et al. Combined application of diclofenac and celecoxib with an opioid yields superior efficacy in metastatic bone cancer pain: a randomized controlled trial. Int J Clin Oncol 2017; 22 (5): 980–5. DOI: 10.1007/s10147-017-1133-y
31. Gaertner J, Stamer UM, Remi C et al. Metamizole/dipyrone for the relief of cancer pain: A systematic review and evidence-based recommendations for clinical practice. Palliat Med 2017; 31 (1): 26–34. DOI: 10.1177/ 0269216316655746
32. Derry S, Wiffen PJ, Moore RA et al. Oral nonsteroidal anti-inflammatory drugs (NSAIDs) for cancer pain in adults. Cochrane Database Syst Rev 2017; 7: CD012638. DOI: 10.1002/14651858.CD012638.pub2
33. McNicol E, Strassels SA, Goudas L et al. NSAIDS or paracetamol, alone or combined with opioids, for cancer pain. Cochrane Database Syst Rev 2005; 1: CD005180.
34. Reid J, Hughes CM, Murray LJ et al. Non-steroidal anti-inflammatory drugs for the treatment of cancer cachexia: a systematic review. Palliat Med 2013; 27 (4): 295–303. DOI: 10.1177/0269216312441382
35. Каратеев А.Е., Насонов Е.Л., Ивашкин В.Т. и др. Рациональное использование нестероидных противовоспалительных препаратов. Клинические рекомендации. Научно-практическая ревматология. 2018; 56: 1–29. DOI: 10.14412/1995-4484-2018-1-29 / Karateev A.E., Nasonov E.L., Ivashkin V.T. i dr. Racional'noe ispol'zovanie nesteroidnyh protivovospalitel'nyh preparatov. Klinicheskie rekomendacii. Nauchno-prakticheskaya revmatologiya. 2018; 56: 1–29. DOI: 10.14412/1995-4484-2018-1-29 [in Russian]
36. Абузарова Г.Р. Нейропатический болевой синдром в онкологии: эпидемиология, классификация, особенности нейропатической боли при злокачественных новообразованиях. Рос. онкологич. журн. 2010; 5: 50–5. / Abuzarova G.R. Nejropaticheskij bolevoj sindrom v onkologii: epidemiologiya, klassifikaciya, osobennosti nejropaticheskoj boli pri zlokachestvennyh novoobrazovaniyah. Ros. onkologich. zhurn. 2010; 5: 50–5. [in Russian]
37. Gilron I, Flatters SJ. Gabapentin and pregabalin for the treatment of neuropathic pain: a review of laboratory and clinical evidence. Pain Res Manag 2006; 11 (Suppl. A): 16A–29A.
38. Attal N. Drug treatment for neuropathic pain. Vol. 37. Issue 2. Part 2;
p. 346–53.
39. Приказ Министерства здравоохранения Российской Федерации от 22 апреля 2014 года N 183н «Об утверждении перечня лекарственных средств для медицинского применения, подлежащих предметно-количественному учету» http://www. consultant.ru/document/cons_ doc_LAW_166181/ Prikaz Ministerstva zdravoohraneniya Rossijskoj Federacii ot 22 aprelya 2014 goda №183n «Ob utverzhdenii perechnya lekarstvennyh sredstv dlya medicinskogo primeneniya, podlezhashih predmetno-kolichestvennomu uchetu» http://www.consultant.ru/document/ cons_ doc_LAW_ 166181/ [in Russian]
40. Приказ Минздрава России от 30.06.2015 №386н «О внесении изменений в приложения к приказу Министерства здравоохранения Российской Федерации от 20.12.2012 №1175н "Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения"». / Prikaz Minzdrava Rossii ot 30.06.2015 №386n "O vnesenii izmenenij v prilozheniya k prikazu Ministerstva zdravoohraneniya Rossijskoj Federacii ot 20.12.2012 №1175n "Ob utverzhdenii poryadka naznacheniya i vypisyvaniya lekarstvennyh preparatov, a takzhe form recepturnyh blankov na lekarstvennye preparaty, poryadka oformleniya ukazannyh blankov, ih ucheta i hraneniya" [in Russian]
Портал Consilium Medicum:
https://con-med.ru/magazines/contemporary/contemporary-02-2018/diagnostika_i_ratsionalnaya_terapiya_khronicheskoy_boli_u_onkologicheskikh_patsientov/

